8.2. МІГРАЦІЯ РАДІОНУКЛІДІВ У НАВКОЛИШНЬОМУ СЕРЕДОВИЩІ І ОБ’ЄКТАХ СІЛЬСЬКОГО ГОСПОДАРСТВА ЧАСТИНА 2 (+КОНТРОЛЬНІ ЗАПИТАННЯ)
| Сайт: | Навчально-інформаційний портал НУБіП України |
| Курс: | Сучасні проблеми радіобіології та радіоекології |
| Книга: | 8.2. МІГРАЦІЯ РАДІОНУКЛІДІВ У НАВКОЛИШНЬОМУ СЕРЕДОВИЩІ І ОБ’ЄКТАХ СІЛЬСЬКОГО ГОСПОДАРСТВА ЧАСТИНА 2 (+КОНТРОЛЬНІ ЗАПИТАННЯ) |
| Надруковано: | Гість-користувач |
| Дата: | четвер, 22 січня 2026, 12:14 |
Опис
План лекції
1. Визначення радіобіології та її місце серед суміжних наук.
2. Напрями розвитку радіобіології та її задачі.
3. Історія радіобіології: етапи розвитку.
4. Сучасні проблеми радіобіології та радіоекології.
5. Необхідність широкої пропаганди радіобіологічних знань.
Зміст
- 1. Надходження радіонуклідів до організму тварин
- 2. Особливості біологічної дії інкорпорованих радіонуклідів
- 3. Дія інкорпорованих радіонуклідів на рослини
- 4. Дія інкорпорованих радіонуклідів на організм тварин
- 5. Небезпека інкорпорування гарячих частинок
- 6. Принципи дозиметрії випромінювань інкорпорованих радіонуклідів
- 7. Контрольні запитання до лекцій 7-8:
1. Надходження радіонуклідів до організму тварин
Надходження радіоактивних речовин в організм тварин відбувається через шлунково-кишковий тракт, органи дихання, а також крізь ушкоджені і неушкоджені шкіряні покриви. Аеральний шлях надходження, тобто через органи дихання, має вагомий внесок лише у період випадання радіоактивних опадів. Незначним є також проникнення радіоактивних речовин через шкіру – перкутальний шлях. Головним шляхом залучення їх у тваринний організм, як і організм людини, слід вважати пероральний – тобто з їжею та водою.
Доля радіоактивних речовин в організмі тварин не відрізняється від такої звичайних стабільних хімічних речовин, які входять до складу кормів. Надходячи до шлунково-кишкового тракту, кормові продукти піддаються механічній та біологічній обробці, перетворюючись на сполуки, які можуть бути засвоєні організмом. В процесі метаболізму радіоактивних речовин в організмі тварин розрізняють два етапи.
Перший етап – це перетворення їх у зручні для засвоєння форми. Для цього у шлунково-кишковому тракті є усі сприятливі умови: здатність до механічного руйнування та подрібнення їжі в шлунку; велика кількість різноманітних ферментів, які здійснюють початкові стадії розщеплення білків, жирів та вуглеводів на більш прості сполуки; зрештою, кисле середовище, що забезпечується за рахунок шлункового соку, яке сприяє переходу радіоактивних кормів у легкозасвоюваний розчинний стан.
Другий етап метаболізму – це всмоктування радіоактивних речовин у шлунково-кишковому тракті. Встановлено, що вони вбираються практично на всьому його протязі, хоча інтенсивність цього процесу на різних ділянках неоднакова: в шлунку, сліпій та дванадцятипалій кишках вона мінімальна; у товстій, порожній та клубових кишках – середня і в тонкому кишечнику – максимальна. Процес всмоктування залежить від багатьох умов, зокрема, характеру корму, його кількості, ступеня забруднення радіоактивними речовинами, їхньої розчинності. Але головними факторами, що визначають рухливість радіонуклідів в організмі тварин, в тому числі і всмоктування, є їх фізико-хімічні характеристики, форми сполук, вид тварин, їх вік, фізіологічний стан – ті ж самі, що визначають долю радіонуклідів в рослинах.
Для оцінки ступеня всмоктування радіонуклідів в шлунково-кишковому тракті використовують коефіцієнт всмоктування (КВС), який являє собою відношення кількості радіонуклідів, що знаходяться у крові до їх кількості, що надійшла з раціоном і виражається в процентах. В таблиці наведені значення КВС деяких радіонуклідів у п'яти видів сільськогосподарських тварин, які свідчать про те, що їх засвоєння може варіювати у дуже широких межах.
Коефіцієнти всмоктування (КВС) радіонуклідів у шлунково-кишковому
тракті дорослих сільськогосподарських тварин, % від введеної кількості
(А.М. Сироткін, 1991)
|
Радіонуклід |
Велика рогата худоба |
Вівці |
Кози |
Свині |
Кури |
|
3H |
92 |
70–100 |
70–100 |
70–100 |
95 |
|
45Ca |
11 |
35 |
20 |
– |
50–60 |
|
54Mn |
0,5–1 |
46 |
1–20 |
7–20 |
20–44 |
|
59Fe |
4 |
1–20 |
1–20 |
17–21 |
72 |
|
60Co |
2,4 |
3,5 |
5 |
3 |
35 |
|
65Zn |
11 |
10 |
1–20 |
51 |
64 |
|
89,90Sr |
6–16 |
7–10 |
3–14 |
13 |
50–80 |
|
88,90Y |
0,05 |
0,05 |
1 |
1 |
<1 |
|
95Zr |
<0,1 |
<1 |
<1 |
<1 |
<1 |
|
103,106Ru |
2 |
0,2 |
0,1 |
1 |
3 |
|
131I |
100 |
100 |
70–100 |
33–76 |
75–80 |
|
134,137Cs |
50–75 |
57 |
68 |
100 |
67 |
|
140Ba |
5 |
1–20 |
1–20 |
1–20 |
1–20 |
|
141,144Ce |
0,1 |
0,04 |
1 |
0,5 |
<1 |
|
210Pb |
0,01 |
– |
– |
– |
– |
|
238U |
1,2 |
<1 |
<1 |
1,9 |
1,5 |
Так, якщо всмоктування 131І у жуйних тварин досягає 100%, то у свиней воно в 1,3–3 рази менше. Навпаки, радіоцезій всмоктується у свиней на 100%, а у жуйних – в 1,3–2 рази менше. В курей всмоктування 59Fe та 60Со значно вище, ніж у жуйних.
Всмоктування радіонуклідів залежить від віку тварин і у молодих особин для деяких з них наближається до 100%, в 5–15 разів перевищуючи всмоктування дорослими тваринами. Безсумнівно, це пояснюється високою проникністю кишкових стінок молодих тварин та меншою потребою дорослих тварин у мінеральних речовинах.
І все ж таки, хоча швидкість всмоктування радіонуклідів різна, вже через 24 год. після їх надходження до шлунково-кишкового тракту у ньому залишається не більш, як 10–15% від їх первинної кількості.
Радіонукліди, що всмокталися у кров, розповсюджуються з її током по органах і тканинах тварини, де частково затримуються, вибірково концентруючись в окремих органах. Та більша їх частина одразу виводиться з організму.
Доля радіонуклідів, які беруть участь в обміні, неоднакова. Як правило, вони затримуються у тих тканинах і органах, до складу яких входять їх стабільні ізотопи і елементи з аналогічними хімічними властивостями. Оскільки хімічний склад тканин сільськогосподарських тварин вивчений досить добре, можна передбачати, до яких саме частин організму потрапить той чи інший радіонуклід.
Існує три основних типи розподілу радіонуклідів в організмі хребетних тварин: скелетний, дифузний та ретикулоендотеліальний. Скелетний тип властивий, перш за все, радіонуклідам лужноземельної групи, головними представниками якої є ізотопи кальцію та стронцію. В мінеральній частині скелету накопичуються також ізотопи барію, радіоактивні елементи радій, плутоній, уран та деякі інші. Дифузний тип характерний для ізотопів лужних елементів: калію, натрію, цезію, рубідію, а також водню, азоту, вуглецю,олонію. Ретикулоендотеліальне* розподілення властиве для рідкоземельних металів: церію, прометію, а також цинку, торію, частково трансуранових елементів.
*Ретикулоендотеліальна система (від лат. reticulum – сіточка), система клітин сполучної тканини в організмі хребетних тварин і людини, здатних до фагоцитозу – знищенню чужорідних клітин, в т.ч. хвороботворних бактерій. Включає певні клітини кісткового мозку, лімфатичних вузлів, мигдаликів, селезінки, печінки, надниркової залози, гіпофізу та деякі інші.
Для деяких радіонуклідів властивий дуже високий ступінь нагромадження в окремих спеціалізованих органах і тканинах. Так, ізотопи йоду нагромаджуються у великих кількостях у щитовидній залозі, що відбувається внаслідок специфіки обміну речовин цього органу. Іноді виділяють навіть спеціальний тип розподілу радіонуклідів – тиреоїдний (від лат. glandula thyreoidea – щитовидна залоза).
Ступінь радіаційного впливу радіоактивних речовин на окремі органи і в цілому на тварину залежить від часу перебування їх в організмі. Деякі з них, які залучаються до процесів обміну швидко метаболізуючих тканин, можуть протягом короткого часу виводитись з організму разом з продуктами метаболізму. Так, ізотоп водню тритій, який бере участь в обміні разом з водою, протягом кількох тижнів практично повністю виводиться з організму ссавців з сечею. В той же час 45Са та 90Sr, що приймають участь у формуванні скелету, можуть, практично не зменшуючись кількісно, перебувати в організмі тварини протягом всього її життя.
Для характеристики строків перебування в організмі окремих радіонуклідів існує поняття періоду піввиведення радіоактивного ізотопу з організму. Період піввиведення (Тб) – це час, протягом якого кількість нагромадженого в організмі (іноді в окремому органі) радіонукліду зменшується удвічі внаслідок процесів біологічного виділення у перебігу природних процесів обміну. В таблиці наведені опосередковані дані тривалості періодів піввиведення з організму людини деяких радіоактивних ізотопів, які нагромаджуються в тілі і окремих органах.
Періоди піврозпаду та піввиведення деяких радіонуклідів
з організму людини (В.Ф. Козлов, 1987)
|
Радіонуклід |
Місце нагромадження |
(Т1/2) |
(Тб) |
|
3H |
Все тіло |
12,33 роки |
12 діб |
|
|
Все тіло |
5479 років |
10 діб |
|
Кістки |
5479 років |
40 діб |
|
|
24Na |
Все тіло |
0,63 доби |
11 діб |
|
32P |
Все тіло |
14,3 доби |
267 діб |
|
Кістки |
14,3 доби |
3,16 роки |
|
|
35S |
Все тіло |
87,1 доби |
90 діб |
|
Кістки |
87,1 доби |
1,64 роки |
|
|
42K |
Все тіло |
0,52 доби |
58 діб |
|
60Co |
Все тіло |
5,21 роки |
9,5 доби |
|
90Sr |
Кістки |
29 років |
50 років |
|
131I |
Все тіло |
8 діб |
138 діб |
|
Щитоподібна залоза |
8 діб |
138 діб |
|
|
137Cs |
Все тіло |
30 років |
70 діб |
|
140Ba |
Все тіло |
12,8 доби |
65 діб |
|
210Po |
Все тіло |
138,4 доби |
30 діб |
|
226Ra |
Кістки |
1 616 років |
44,9 роки |
|
235U |
Все тіло |
712 000 000 років |
100 діб |
|
Кістки |
712 000 000 років |
300 діб |
|
|
239Pu |
Все тіло |
24 383 роки |
178 років |
|
Кістки |
24 383 роки |
200 років |
Вони в цілому відбивають загальні тенденції поведінки таких ізотопів в організмі сільськогосподарських тварин-ссавців, хоча, звичайно, абсолютні показники часу дещо відрізняються внаслідок біологічних особливостей видів.
Значно впливає на виведення радіонуклідів з організму та відкладення їх в окремих тканинах і органах продуктивних тварин має швидкість їхнього руху у процесі метаболізму, яка врешті-решт призводить до переходу і накопиченню в молоці та м'ясі – продуктах, що є основним джерелом надходження радіонуклідів в організм людини. Так, у теперішній час внесок молока, як джерела 137Сs і 90Sr досягає 70% всієї їх кількості в раціоні людини. Ступінь переходу радіонуклідів в молоко та м'ясо характеризує коефіцієнт переходу (КП), який оцінюють аналогічно коефіцієнту всмоктування (КВС).
Максимальні величини виділення радіонуклідів з молоком характерні для 32Р,
Ступінь переходу радіонуклідів в молоко та м'ясо характеризує коефіцієнт переходу (КП), котрий оцінюється аналогічно коефіцієнту всмоктування (КВС).
Найбільш високі значення КП з наведених мають радіонукліди цезію (як і калію, значення для якого тут не приводяться) – хімічного аналогу калію, іони якого відіграють важливу роль в генерації та проведенні біоелектричного потенціалу у м'язах, регуляції їх скорочення. Разом з калієм в процеси обміну та нагромадження у м'язах втягується і цезій.
Радіонукліди-представники рідкоземельних та важких металів, а також трансуранові елементи, як правило, переходять із раціону в молоко та м'ясо у незначних кількостях.
Слід відзначити, що і для ссавців тривалість періоду піввиведення радіонукліду у значній мірі залежить чи навіть визначається характером метаболізму. Так, для людини в залежності від віку період піввиведення 90Sr з кісток варіює від 25 у дітей до 70–75 років у стариків, а 137Сs з м'язів – відповідно, від 30 до 90 діб.
У цій же таблиці наведені також значення періодів піврозпаду радіонуклідів. На відміну від досить варіюючи значень періодів піввиведення, ця величина, яка визначається за допомогою даних про середній час існування радіоактивних ядер, становить сталу величину, яка не залежить від будь-яких факторів.
Але, визначаючи ступінь очищення організму від радіонуклідів, необхідно враховувати і цей показник, тому що зменшення кількості радіоактивних речовин, як і дії іонізуючих випромінювань, йде водночас і за рахунок їх виведення і розпаду. В такому разі говорять про ефективний період піввиведення радіонукліду (ТЕФ), який визначається за формулою
ТЕФ = Т0,5 × Тб / Т0,5 + Тб
де Т0,5 – період піврозпаду радіонукліду і Тб – період його піввиведення.
Цілком природно, що шляхи надходження та міграції радіонуклідів в організмі людини принципово не відрізняються від таких у тварин-ссавців. Деякі ж їх особливості, як і специфічність дії випромінювань окремих радіонуклідів на людину вивчає радіаційна медицина.
2. Особливості біологічної дії інкорпорованих радіонуклідів
Практичне значення вивчення поведінки радіонуклідів у природному середовищі зумовлене перш за все можливими радіаційними наслідками при їх переході в харчові продукти. В загальній схемі досліджень, що пов'язані з визначенням шляхів міграції радіонуклідів в біосфері, найважливіше місце належить їх поведінці в біологічних і харчових ланцюжках з участю сільськогосподарських рослин та сільськогосподарських тварин. Це зумовлене тим, що споживання продуктів рослинного і тваринного походження, забруднених радіоактивними речовинами, є основним шляхом формування дози внутрішнього опромінення, а, практично, загальної дози, яку одержує організм у звичайний час, так як компонент дози зовнішнього опромінення не перевищує 20–25%. Саме тому вивчення особливостей дії інкорпорованих радіонуклідів є важливим завданням радіобіології.
Інкорпоровані радіонукліди – це такі, що при надходженні в організм включилися всередину клітин і тканин рослин, тварин, людини. Радіонукліди, які надійшли до шлунково-кишкового тракту і нібито знаходяться у середині організму, не можна вважати інкорпорованими, так як більшість їх виводиться з організму транзитом з каловими масами і тільки частина всмоктується у кров, включається у метаболізм і може увійти до складу клітин і тканин.
При надходженні до організму радіоактивних речовин в залежності від їх фізико-хімічних характеристик, кількості, місць локалізації та часу знаходження в організмі, можуть спостерігатися такі ж самі радіобіологічні ефекти, що і при еквівалентних поглинених дозах зовнішнього опромінення, які були розглянуті у розділі 5: радіаційна стимуляція, морфологічні зміни, променева хвороба, прискорення старіння та скорочення тривалості життя, загибель, генетична дія. І ще зовсім недавно, в 1950-60-і роки, в умовах недостатньої кількості джерел зовнішнього опромінення у наукових дослідженнях і у практиці сільського господарства для індукції ефекту радіаційної стимуляції у рослин і тварин, а також одержання мутантів в селекційній роботі користувалися розчинами різних радіоактивних ізотопів. При вирощуванні рослин на розчинах радіоактивних речовин з коротким періодом піврозпаду, які мають високі концентрації радіоактивних ізотопів і досить жорстке випромінювання, наприклад 32Р, виникає типова променева хвороба, яка супроводжується характерними порушеннями метаболізму, наявністю морфологічних змін, цілком аналогічних тим, що виникають при загальному зовнішньому опроміненні.
Проте, у багатьох випадках інкорпоровані радіонукліди при рівних дозах з загальним зовнішнім опроміненням можуть являти більш високу небезпеку для організму. Це зумовлене рядом особливостей.
Першою і головною з них є здатність деяких радіонуклідів вибірково нагромаджуватись в окремих тканинах і органах. Якщо при зовнішньому опроміненні всі тканини опромінюються рівномірно, то у випадках внутрішнього опромінення може відбуватися формування високих локальних доз для деяких тканин та органів, що обумовлюється хімічними властивостями радіонукліду, специфікою метаболізму речовин, до складу яких він входить, біологічними особливостями організму.
Другою важливою особливістю інкорпорованих радіонуклідів є збільшення, часом дуже велике, небезпеки дії α- і β-випромінювачів, які внаслідок низької проникаючої здатності у речовину не викликають загрози або мало впливають на внутрішні тканини організму в умовах зовнішнього опромінення, проте можуть ставати надзвичайно сильними джерелами радіаційного ураження при надходженні всередину організму. Особливо це стосується нуклідів джерел α-випромінювання: плутонію, америцію, кюрію, радію, урану та інших, які, маючи високу відносну біологічну ефективність (ВБЕ), можуть викликати важкі радіаційні ушкодження.
Третьою особливістю дії інкорпорованих радіонуклідів є, як правило, довгі строки опромінення організму. Дані свідчать про те, що періоди піврозпаду та піввиведення багатьох радіонуклідів, зокрема 90Sr та 239Рu, дуже великі – під їх впливом організм зазнає хронічного опромінення протягом всього життя.
Досить важливою особливістю внутрішнього опромінення слід вважати те, що від нього важко захиститися за допомогою звичайних радіозахисних засобів, які діють при зовнішньому опроміненні. Можливості ж прискорення виведення з організму радіоактивних речовин, про що буде йти мова далі, надто невеликі.
Відзначені специфічні властивості радіаційного ураження інкорпорованими радіонуклідами стосуються головним чином організму тварин і, що найважливіше, людини. Рослині у даному випадку звичайно належить роль проміжної, але першої і основної, ланки на недовгому шляху транспортування їх із ґрунту.
3. Дія інкорпорованих радіонуклідів на рослини
Радіочутливість рослин до іонізуючого випромінювання, яке виникає внаслідок нагромадження у тканинах радіоактивних речовин, вивчена значно в меншій мірі, ніж чутливість до випромінювання зовнішніх джерел. Головним чином це зумовлене тим, що більшість видів рослин має більш високу радіостійкість, ніж тварини, і навіть при накопиченні радіонуклідів у значних кількостях радіобіологічні ефекти в них проявляються у меншій мірі. Однак, у багатьох відносно радіочутливих видів інкорпоровані радіонукліди можуть призводити до досить помітних пошкоджень.
Вище відзначалося, що найрадіочутливішими із сільськогосподарських рослин є деякі представники родини бобових (боби, горох, квасоля, соя), для яких ЛД50 складають лише 3–15 Гр. Всі бобові є кальцієфілами і здатні разом з кальцієм нагромаджувати у великих кількостях його хімічний аналог стронцій, в тому числі і радіостронцій, створюючи тим самим умови для сильного внутрішнього опромінення цих видів рослин.
Окремі радіонукліди не тільки по-різному нагромаджуються видами рослин, але й по-різному концентруються в окремих їх органах і тканинах, ведучи до неоднакового ступеня опромінення. На радіоавтографах рослин, які одержують при введенні в них радіоактивних ізотопів, буває добре визначена ця нерівномірність їх розподілу, чітко просліджуються місця концентрування, зосереджені, як правило, в органах і тканинах, які мають високу метаболічну та мітотичну активність, і, безперечно, у провідних тканинах – судинах. Такими є меристеми і генеративні органи – критичні тканини рослин, радіочутливість яких найвища. Саме тому не тільки при зовнішньому, але й при внутрішньому опроміненні радіобіологічні ефекти в першу чергу проявляються на цих тканинах. Зокрема, в клітинах меристем з'являються аберації хромосом, спостерігається сповільнення поділу клітин, наслідком якого є формування різного роду морфологічних змін на листі та інших органах, гальмування ростових процесів – все це характерні ознаки променевої хвороби рослин.
Високою радіочутливістю серед рослин, як і взагалі серед живих організмів, характеризується сосна. Підчас аварії на Чорнобильській АЕС спостерігалось значне нагромадження в рослинах сосни різних радіонуклідів за рахунок позакореневого їх надходження у рослини. В місцях з високим рівнем радіонуклідного забруднення саме в меристемах виявляли найбільш сильні пошкодження, що вели до масової їх загибелі, проліферації бокових бруньок з невпорядкованою орієнтацією, утворення вкорочених пагонів з дрібною або велетенською хвоєю, викривлення голок хвої, порушення орієнтації нових пагонів.
Звісно, у даному випадку важко говорити тільки про внутрішнє опромінення рослин. При аварії на рослини діяло і зовнішнє опромінення, особливо велике у перші дні-тижні після її початку. І в подальшому певна доза зовнішнього опромінення формувалась від радіоактивних опадів, що потрапили на поверхню землі, частинок, які знаходились на поверхні рослин і не проникли всередину.
Саме тому через декілька років, коли радіаційний фон знизився в сотні разів, відмічалось і зменшення кількості різних аномалій. Але вже через 3-4 роки були одержані свідчення про потужне кореневе надходження радіонуклідів у надземні органи не тільки однорічних, але й багаторічних рослин і реєстрували деякі радіобіологічні ефекти, зумовлені переважно за рахунок внутрішнього опромінення. І тепер на місці заритих рештків „Рудого лісу” виростають молоді сосни з різними морфологічними порушеннями.
Відома й велика кількість спеціальних досліджень, в яких окремі радіоактивні ізотопи вводились в рослину, звичайно через корені. Звісно, і в цьому випадку не можна повністю заперечувати відсутність зовнішнього опромінення. Але внесок його, безумовно, не порівняний з часткою внутрішнього опромінення. Найбільш показові в цьому відношенні експерименти з введенням α-випромінювачів або сполук, що містять низько енергетичний β-випромінювач – радіоактивний ізотоп водню тритій, які характеризуються мікронними пробігами частинок в тканинах і при введенні яких в організм практично повністю виключається ймовірність зовнішнього опромінення. Особливо яскравими є досліди з міченим по тритію тимідіном (3Н-тимідін) – специфічним попередником синтезу ДНК, який при введенні в рослину чи інший живий об'єкт концентрується саме в тих клітинах, що діляться, включаючись у ДНК. У цій ситуації він спроможний викликати розриви полінуклеотидних ланцюгів молекули, призводячи до порушень синтезу ДНК, РНК, білків та інших ланок метаболізму, які зрештою є механізмом індукції всіх радіобіологічних ефектів.
Активну участь в процесах поділу і росту клітин приймає калій. В рослинах його хімічний аналог цезій, в тому числі і радіоактивний 137Сs, концентрується переважно в тих клітинах, які активно діляться і ростуть, піддаючи їх потужному опроміненню. Зокрема встановлено, що в меристемах коренів (зона поділу) концентрується значно більше цього ізотопу, ніж у клітинах решти частини кореня, тобто поглинута меристемою доза за рахунок радіоцезію у декілька і більше разів вища, ніж іншими тканинами. Отже, стає зрозумілим, здавалося б парадоксальне явище, коли на забруднених радіонуклідами землях радіобіологічні ефекти, що спостерігаються у рослин, часто-густо відповідають дозам зовнішнього опромінення на порядок вищим, ніж ті, які вдається розрахувати, або оцінити за допомогою звичайних дозиметрів.

Функції кальцію в житті рослин, на відміну від тварин, більш скромні – основна його кількість іде на створення та зміцнення оболонок диференційованих та спеціалізованих клітин, в тому числі і клітин провідної зони кореня, радіостійкість яких у десятки і сотні разів вища за клітини, що діляться. Подібним чином веде себе і його хімічний аналог стронцій. Тому і ушкоджуюча дія 90Sr на рослини за певних обставин може бути значно меншою, ніж 137Cs.
При інкорпоруванні радіоактивних речовин їх поведінка в рослині та радіобіологічна ефективність у значній мірі залежать від хімічних та біохімічних властивостей сполук, у формі якої вони знаходяться. Одні сполуки можуть активно включатися у метаболізм, транспортуючись по рослині досить з великою швидкістю і нагромаджуватись в найбільш чутливих до опромінення місцях. Другі, маючи той же радіонуклід, але у формі іншої сполуки, можуть накопичуватись десь “на вході”, наприклад в коріннях, і далі практично не пересуватись, або навпаки, швидко рухатися і виводитися з рослини. Так, вже відзначалось, що тритій у складі тимідіну включається в ДНК, зумовлюючи різноманітні радіобіологічні ефекти. Він же у складі води відразу вступає в кругообіг і виводиться з рослини, призводячи до порівняно незначних ушкоджень.
В той же час 90Sr, який надходить в рослини у вигляді таких, наприклад, сполук, як нітрат або фосфат стронцію, може зв'язуватися з ДНК та білками хроматину, локалізуючись в ядрах саме тих клітин, що активно діляться. Щодо 137Сs, то він, наприклад, у формі хлориду розподіляється по клітині більш чи менш рівномірно. У такі ситуації можна очікувати більш високу пошкоджуваність клітин радіостронцієм, ніж радіоцезієм при введенні їх в рослини у рівних кількостях за радіоактивністю.
Є чимало даних, які свідчать про високий ступінь пошкодження хвойних рослин при опроміненні інкорпорованими радіоактивними речовинами. Так, при аварії на Південному Уралі 1957 р., коли радіоактивні речовини у вигляді легко засвоюваних надземними органами рослин гідрозолей випали на дерева сосни та ялини, дози опромінення при нагромадженні їх в меристемах хвої та бруньок досягали 5–30 Гр. При цьому на фоні масових анатомічних порушень спостерігали сповільнення розпускання бруньок, утворення вкорочених в спотворених пагонів, зміну кольору хвої, зокрема її пожовтіння, побуріння, почервоніння (ті ж ефекти, що і у “Рудому лісі” при зовнішньому чи змішаному опроміненні), усихання гілок. При дозі 50 Гр і вище дерева гинули.
А.Ф. Тихомиров (1982), моделюючи таку ситуацію, проводив експерименти, в яких шляхом обприскування вносив радіоактивний стронцій у крони сосни, створюючи щільність забруднення (3–60).107Бк/м2. При цьому дози, які нагромаджувались меристематичними тканинами протягом періоду вегетації, складали від 2 до 20 Гр. І вже мінімальні з них викликали зменшення приросту пагонів, зміну їх форми, довжини, орієнтації. За максимальних доз спостерігали усихання крони та відмирання дерев.
Але для більшості радіостійких видів рослин згадані соматичні радіобіологічні ефекти реєструються, як правило, за рівнів нагромадження радіонуклідів та формування доз внутрішнього опромінення у декілька разів більших. Це однак не означає, що низькі дози нешкідливі для них. При повному видимому благополуччі процвітання радіостійкого виду за рівнів доз, які пригнічують рослини родин лілейних, соснових, бобових, у його представників нерідко спостерігають збільшення кількості аберацій хромосом у соматичних та статевих клітинах, інші форми порушень, які можуть виявитись у віддалені періоди, в тому числі у наступних поколіннях. Відзначають і підвищення ураженості рослин різними хворобами, що свідчить про зниження їх імунного статусу.
Неоднакова і відносна біологічна ефективність випромінювань окремих інкорпорованих радіонуклідів. Найбільш висока вона для α-випромінювачів – зокрема радіонуклідів трансуранових елементів, які, на щастя, в основному нагромаджуються, так би мовити, “на вході”, в коренях, і дуже слабо пересуваються по рослині. Але й потрапивши в корені, вони можуть утворювати осередки потужного опромінення кореневих меристем, зумовлюючи різні типи пошкоджень аж до сповільнення росту. γ-випромінювання 131І, 137Сs є більш проникаючим і, відповідно, більш пошкоджуючим, ніж відносно м'яке β-випромінювання 90Sr.
Всі перераховані особливості інкорпорованих радіонуклідів зумовлюють найрізноманітніші радіобіологічні ефекти при їх надходженні у рослини. Так, при різних рівнях радіонуклідного забруднення ґрунтів спостерігали більш раннє цвітіння і достигання деяких культур (радіаційна стимуляція), зміну форми листя та їх гігантизм (морфологічні зміни), пригноблення росту та розвитку (променева хвороба), збільшення в пилку специфічних мутацій, набуття у дочірніх рослин нових ознак (генетична дія).
Але все-таки треба визнати, що головна небезпека нагромадження рослинами радіонуклідів полягає не в їх радіаційній небезпеці для самих рослин, а в тому, що вони є дуже важливою ланкою міграційного ланцюжка на шляху передачі радіонуклідів більш радіочутливим видам – сільськогосподарським продуктивним тваринам і людині.
4. Дія інкорпорованих радіонуклідів на організм тварин
Специфіка прояву радіобіологічних ефектів інкорпорованих радіоактивних речовин у тварин в значній мірі визначається їх властивістю нагромаджуватись у певних місцях організму, створюючи осередки сильного опромінення. Зокрема, до 30–50% 131І може нагромаджуватись у щитовидній залозі, яка складає лише 0,02–0,05% маси тіла. Майже виключно в кістках накопичується 90Sr. Це зумовлено специфікою будови органів тварин та фізіолого-біохімічною роллю, яку відіграють окремі хімічні елементи та їх аналоги у виконанні певних функцій.
Так, щитоподібна залоза – це виключно спеціалізований ендокринний орган хребетних тварин, що відповідає за вироблення гормонів тироксину та трийодтироніну, котрі беруть участь в регуляції обміну речовин та енергії в організмі. Для нормального функціонування цього органу, від якого залежать такі основні процеси, як ріст, розвиток, диференціація і спеціалізація тканин, у відносно великих кількостях потрібен йод. Він надходить в організм з продуктами харчування, водою, повітрям у формі стабільного ізотопу 127І. Але в ґрунтах та рослинах деяких нечорноземних, степових, пустельних, гірських біогеохімічних зон йод знаходиться у недостатніх кількостях або незбалансований з деякими іншими елементами (Со, Мn, Сu). В Україні до таких в першу чергу належить Полісся – регіон, який у найбільшій мірі постраждав під час аварії на Чорнобильській АЕС. В числі викинутих у навколишнє середовище ізотопів знаходилися і радіоактивні ізотопи йоду 131І, 133І та інші. Не відрізняючись за хімічними властивостями від нерадіоактивного йоду, вони можуть надходити в організм тварин та людини і нагромаджуватись у щитоподібній залозі, піддаючи її досить жорсткому γ-опроміненню, особливо у великих кількостях при дефіциті йоду в кормах і продуктах харчування. Саме така ситуація склалася в перші тижні (період піврозпаду найдовгоживучого ізотопу йоду 131І складає 8 діб) після початку аварії на значних територіях України, Білорусі, Росії.
Найбільша концентрація 131І в щитоподібній залозі ссавців при тривалому надходженні в організм спостерігається на 10–15-у добу. Коефіцієнт нагромадження (КН) 131І її тканинами у порівнянні з іншими органами в сотні і тисячі разів вищий. Так, якщо прийняти його значення у крові, м'язовій тканині, селезінці та підшлунковій залозі за одиницю, то у нирках, печінці і яєчниках він становить 2–3, у слинних залозах і сечі – 3–5, у фекаліях та молоці – 5–15, а у щитоподібній залозі досягає 8000–10000.
Проте основна частина дози за рахунок радіойоду (до 80%) формується вже протягом перших 4-х діб. Це зумовлене тим, що до його складу входять і інші ізотопи з більш короткими періодами піврозпаду, наприклад 133І (20,8 год.), 135І (6,6 год.), за рахунок яких може формуватись частка дози, більша, ніж за рахунок 131І. Дози локального опромінення щитоподібної залози при цьому можуть досягати десятків і сотень грей. Це веде до порушень структури і функцій цього важливого органу, зменшенню його розмірів аж до повного руйнування. Навіть порівняно невисокі дози, які зумовлюють місцеві некрози, фіброз, розростання рубцевої тканини та гіпофункцію щитоподібної залози, можуть призводити до зниження імунітету, погіршенню відтворювальної функції скороченню періоду лактації у корів, прояву негативних наслідків у нащадків.
Багато радіонуклідів з кров'яного русла вибірково депонуються в кістках і, як правило, тривалий час затримується в них, внаслідок чого кісткова тканина, а також ті тканини, що у ній знаходяться (в першу чергу червоний кістковий мозок) і перебувають на її поверхні або в межах пробігу частинок або квантів випромінювання, можуть бути піддані радіаційній дії. Такі радіонукліди одержали назву остеотропних. До них належать в першу чергу 45Са та хімічні аналоги кальцію (із штучних, наприклад, 90Sr та його більш енергетичний, але короткоживучий, дочірній продукт ітрій – 90Y; із природних – 226Rа) та актиноїди (із штучних – 239Рu, 241Аm, із природних – 232Тh, 238U). Радіонукліди-аналоги кальцію, як, власне, кальцій, більш-менш рівномірно розподіляються по всьому об'єму кістки. Актиноїди ж першочергово депонуються на внутрішній і зовнішній кісткових поверхнях, однак в подальшому перерозподіляються в об'ємі кісткової тканини.
Концентрації остеотропних радіонуклідів в скелеті тварин, як правило, в сотні разів перевищують їх кількість у м'яких тканинах, створюючи сильні поля опромінення червоного кісткового мозку – найрадіочутливого критичного їх органу. Основне призначення червоного кісткового мозку – продукція зрілих клітин крові. За нормальних умов загибель або зникнення кожного елемента клітини у периферичній крові або на іншій ділянці організму компенсується утворенням клітини в кістковому мозку. Але загибель або пошкодження однієї клітини кісткового мозку може призвести до зникнення чи появи патологічними цілої групи клітин крові, так званої клітинної лінії. При масовому радіаційному ураженні клітин кісткового мозку в організмі розвивається кістково-мозковий синдром, який характеризується спустошенням кісткового мозку і нерідко веде до загибелі тварини.
Для більшості тварин-ссавців і людини летальна доза 90Sr складає 10–40 МБк/кг маси тіла. За менших доз можуть розвиватися хвороби крові типу анемії, лейкозів та інших, які проявляються в сонливості, лихоманці, втраті апетиту, кровоточивості слизових оболонок. В цілому реакція тварин на надходження великих кількостей 90Sr мало відрізняється від реакцій на зовнішнє опромінення, які характерні для прояву різних ступенів променевої хвороби. І це природно, так як в обох випадках в основі радіаційного ураження лежить розвиток саме кістково-мозкового синдрому.
Значно повільніше і в менших кількостях з крові в кісткову тканинy переходять ізотопи плутонію, америцію та інші актиноїди. Але їх α-випромінювання (ядра атомів гелію) проявляє набагато сильнішу руйнуючу дію на кістковий мозок у порівнянні з β-випромінюванням (електрони) 90Sr. До того ж відомо, що плутоній у відносно високих кількостях може нагромаджуватися в яєчниках і сім'яниках тварин, приводячи до опромінення яйцеклітин та сперматогенних клітин. Біологічний ефект радіонукліду при цьому проявляється у зменшенні маси сім'яників та продукції сперми, зниженні продуктивності жіночих статевих гормонів та числа ооцитів, що негативно впливає на потомство. Безсумнівно, опромінення статевих клітин тварин збільшує ймовірність прояву ефектів радіації в наступних поколіннях.
В статевих клітинах, які активно діляться, у великих кількостях нагромаджуються й інші радіонукліди – 45Са, 131І, 137Сs, індукуючи мутації генів і хромосом та інші порушення.
З утворених при радіоактивному розпаді ізотопів цезію найбільш небезпечним для тваринного організму при інкорпоруванні є 137Сs. Потрапивши в організм, він розподіляється більш-менш рівномірно в основному по м'яких тканинах. Відносно високі його кількості нагромаджуються в рухливих активно метаболізуючих тканинах м'язів, зокрема серця. Але високо енергетичне γ-випромінювання 137Сs згубно впливає не тільки на ці тканини, але і на весь організм, в тому числі і на його критичні органи. Саме тому при надходженні в організм тварин цього радіонукліду спостерігаються зміни морфологічного складу кісткового мозку і крові, аналогічні тим, які викликаються дією інкорпорованих радіонуклідів 90Sr, 239Рu, а також загального зовнішнього опромінення.
В період вагітності тварин 137Сs легко проникає з материнського організму у плід. При хронічному надходженні радіонукліду досить швидко відбувається вирівнювання його концентрації в організмах матері та плоду. Швидко проходить передача радіонукліду молодняку тварин і через молоко. Це стосується не тільки 137Сs, але в різній мірі і інших радіонуклідів, в першу чергу 90Sr і 131І.
5. Небезпека інкорпорування гарячих частинок
Особливо небезпечними радіонукліди стають при проникненні в організм у вигляді так званих “гарячих частинок”. До гарячих частинок належать аерозолі мікронного та субмікронного розміру, які мають радіоактивність на декілька порядків вищу, ніж середня активність частинок відповідних параметрів. Звичайно – це частинки реакторного палива, які містять напрацьовані продукти поділу урану, високорадіоактивні частинки, що утворюються при атомних вибухах.
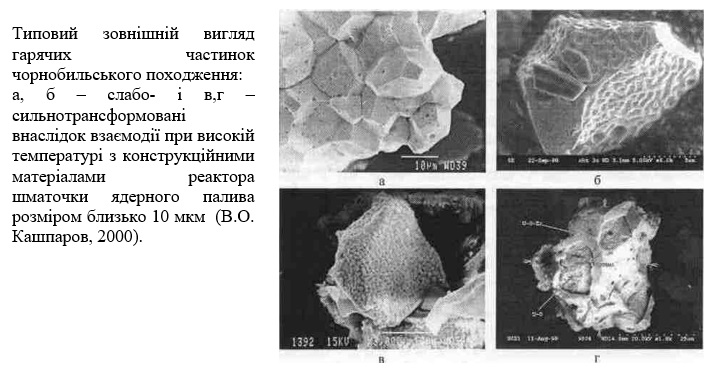
Радіоактивність гарячих частинок дуже висока. В тканині частинка мікрометрового розміру у радіусі до 50 мкм може утворювати дозове поле потужністю до декількох десятків грей на добу, ведучи до загибелі сотень оточуючих її клітин, різним змінам в тисячах клітин.
При попаданні на рослини гаряча частинка, закріплюючись на липкій чи опушеній поверхні, може в буквальному розумінні “випалювати” групи клітин, призводячи до самих різноманітних морфологічних змін в органах. Особливо небезпечним у даній ситуації може бути згаданий флоральний захват, за якого великі частинки можуть попадати всередину квітки і включатись у зав'язь плодів.
З рослинними кормами гарячі частинки потрапляють в організм сільськогосподарських тварин і людини. Але особливо небезпечним шляхом їх проникнення є інгаляційний, який може мати місце не тільки в період випадання радіоактивних опадів, але й при вторинному вітровому підйомі. Якщо при попаданні з кормами більшість гарячих частинок виводиться з організму через шлунково-кишковий тракт, то при попаданні в легені вони закріплюються в альвеолах і внаслідок поганої розчинності виводяться дуже повільно. Знаходячись в легенях, шлунково-кишковому тракті, гарячі частинки утворюють зони дуже інтенсивного опромінення тканин, викликаючи локальну загибель досить великих груп клітин, їх пошкодження, різні перетворення аж до трансформації у злоякісні.
Вважається, що за звичайних умов число гарячих частинок в навколишньому середовищі, зокрема в атмосфері, надзвичайно мале – одна на десятки і тисячі кубічних метрів повітря. Але після ядерних вибухів в атмосфері, викидів радіоактивності при деяких типах радіаційних аварій на підприємствах ядерного паливного циклу їх кількість в різних компонентах довкілля значно зростає. При цьому вони можуть розповсюджуватись на досить великі відстані. Так, паливні частинки чорнобильського походження були виявлені у багатьох країнах Європи: Швеції, Норвегії, Німеччині, Греції, Австрії, Швейцарії, Польщі, Болгарії, Румунії та інших.
6. Принципи дозиметрії випромінювань інкорпорованих радіонуклідів
Специфічність внутрішнього опромінення рослин і тварин, яка обумовлюється дуже різкою нерівномірністю розподілення інкорпорованих радіоактивних речовин в окремих тканинах і органах, дуже утруднює його дозиметрію. Доза опромінення, що формується за рахунок включених всередину організму радіонуклідів, залежить від багатьох факторів, врахувати які не завжди виявляється досить просто: виду радіонукліду, типу сполуки, шляху надходження, швидкості транспортування по організму, місця локалізації, часу розпаду, швидкості виведення із організму та інших. Як правило, з цією метою використовують спеціальні методи із застосуванням складних розрахунків. Але й вони дають лише приблизну уяву щодо справжньої поглинутої дози.
Будучи інкорпорованими протягом деякого часу в органах і тканинах, радіонукліди створюють певний рівень внутрішнього опромінення. Поглинута доза при цьому може бути співставлена з біологічним ефектом, викликаним зовнішнім опроміненням. В цьому розумінні вона виступає як міра радіаційної небезпеки. Однак оцінки абсолютних значень доз при цьому можуть суттєво відрізнятись.
Дуже важливу роль у формуванні дози внутрішнього опромінення має шлях надходження радіонукліду. Найбільш небезпечним з трьох шляхів надходження є інгаляційний, а найбільш складною формою надходження є радіоактивні аерозолі. Зовнішнє опромінення аерозолів у порівнянні з внутрішнім зовсім незначне. Але в процесі дихання аерозольні частинки разом з повітрям через трахею і бронхи потрапляють в альвеолярні тканини, а звідти у лімфатичну систему і кров. Існує думка, що до 50–75% всіх частинок, що вдихаються, затримується в дихальних шляхах. Критичним органом в цьому випадку є легені.
На формування дози великий вплив мають такі фактори, як розмір частинок, швидкість їх виведення з легеневої тканини, вид та енергія іонізуючих випромінювань, розподіл радіоактивності за частинками різного розміру, характер розподілу осілих аерозольних частинок по ділянках органів дихання та інші. Все це створює значні труднощі в безпосередньому визначенні поглинутої дози аерозолів. З цієї причини дозиметрія радіоактивних аерозолів фактично зводиться до їх радіометрії, головне завдання якої – визначення активної концентрації аерозолів в повітрі.
Тому, знаючи споживання повітря за одиницю часу (людина, наприклад, вдихає і видихає за добу в середньому 20 тисяч літрів), концентрацію радіоактивних аерозолів в повітрі, ступінь їх відкладення в легенях, природу радіоактивності, можна оцінити дозу внутрішнього опромінення, яка формується за цих умов.
Але внесок аерального шляху надходження радіоактивних речовин в організм, а, відповідно, і цього виду формування дози, є суттєвим, як вже відзначалось, лише в період випадання радіоактивних опадів. В подальшому основним фактором, який визначає дозу внутрішнього опромінення, є забруднені радіонуклідами корми і вода. В цьому випадку формування дози в кожному органі, в кожній ділянці тканини визначається нагромадженням та виведенням радіонуклідів. І знову ж таки, доза внутрішнього опромінення буде залежати від хімічної форми радіонукліда, виду хімічної сполуки, в який він представлений, та інших факторів, про які вже було сказано.
Мало того, що кількість факторів, якими визначається доза внутрішнього опромінення, дуже велика, більшість із них важко врахувати. Тому для оцінки дози внутрішнього опромінення вдаються до допомоги моделей. Один із підходів – так звані математичні камерні моделі. В них концентрація радіонукліду в тканині в кожен момент визначається водночас триваючими прямими та зворотними процесами – нагромадженням і виведенням. У відповідності з цим можна уявити модель формування кількості радіонукліду на деякій ділянці всередині організму як орган чи тканина, сполучена транспортними комунікаціями з рядом камер (звідки і назва моделей), в яких нагромаджується радіонуклід. Саме ними відбувається приток і стік радіонуклідів. Окремі камери моделі можуть бути зіставлені з реальними ділянками організму, окремими його органами, тканинами. Наприклад, перенесення радіонукліда з кровотоком відбивається моделлю, в якій транспортними комунікаціями слугують кровоносні судини, а камерами – ті ділянки організму, між якими відбувається обмін радіонуклідами.
Математичний аналіз камерних моделей дає змогу встановити концентрацію та швидкість перенесення радіонуклідів в організмі. В ролі вхідних даних слугують концентрації та швидкість надходження радіонуклідів з навколишнього середовища в організм. Зовнішнє середовище розглядається при цьому як одна з камер. В подальшому завдання визначення кількості радіонукліду та оцінки дози внутрішнього опромінення зводиться до вирішення системи лінійних рівнянь балансу швидкості потоків метаболітів, що містять окремі радіонукліди. Безперечно, завдання це досить складне, а результат дозиметрії дуже умовний. Хоча і може дати уявлення про порядки доз, які формуються в тій чи іншій ділянці організму при надходженні певних радіонуклідів.
Звісно, проблема дозиметрії інкорпорованих радіонуклідів стосується головним чином тварин та людини. Рослина в ній розглядається тільки як одне з джерел формування дози. Хоча, безумовно, і при надходженні різних радіонуклідів в рослини, як уже відзначалося, вони нерівномірно розподіляються по ньому, створюючи в окремих місцях осередки високих рівнів опромінення. Але враховуючи труднощі в оцінці доз внутрішнього опромінення, суттєво менше практичне значення цього питання, яке, без сумніву, поступається дозиметрії тварин і людини, воно до кінця не вирішується.
В останні роки все частіше для оцінки одержаних людиною доз опромінення залучаються методи біологічної дозиметрії. Найбільш розповсюджений з них базується на майже лінійній залежності між одержаною організмом поглиненою дозою і кількістю аберацій хромосом у лімфоцитах периферійної крові – своєрідним детекторам іонізуючої радіації всередині організму. Одержані досить задовільні збіжності між оцінками доз за допомогою цього методу і сучасними методами інструментальної та розрахункової дозиметрії. Безперечно, у випадках біологічної дозиметрії реєструється доза загального опромінення – сумарна зовнішнього і внутрішнього опромінення. Але в певних умовах, зокрема в сучасних, які склалися на забруднених радіонуклідами внаслідок аварії на Чорнобильській АЕС територіях, коли внесок внутрішнього опромінення у загальну дозу досягає 95%, методи біологічної дозиметрії можуть стати на нагоді.
Абсолютно незамінними методи біологічної дозиметрії стають при спробах оцінки доз внутрішнього опромінення у рослин. Тут спостерігається чітка залежність між кількістю клітин з абераціями хромосом у меристемах і одержаною дозою. В зв'язку з тим, що і у рослин на забруднених територіях основна частка дози формується за рахунок кореневого надходження радіонуклідів, цей метод дозволяє оцінити саме дозу внутрішнього опромінення. Найбільш часто у якості такого біологічного “дозиметра” використовують меристеми первинних корінців насінин, одержаних від рослин, що виросли на забруднених територіях. Співставлення кривих доза-ефект, одержаних в реальних умовах і умовах досліду, дозволяє скласти уяву про дози опромінення за рахунок інкорпорованих радіонуклідів.
7. Контрольні запитання до лекцій 7-8:
1. Основні шляхи міграції радіоактивних речовин в об’єктах природного
середовища.
2. Поняття трофічного, або харчового, ланцюга.
3. Коефіцієнт накопичення і коефіцієнт переходу радіонукліду.
4. Чинники, що визначають міграцію радіонуклідів в атмосфері.
5. Основні види міграції радіонуклідів в ґрунті.
6. Вплив фізико-хімічних властивостей радіонуклідів на їхню міграцію в ґрунті.
7. Значення механічного та мінералогічного складу ґрунту в міграції
радіонуклідів.
8. Вплив агрохімічних властивостей ґрунту на міграцію радіонуклідів та їхній
перехід в рослини.
9. Вплив погодно-кліматичних умов на міграцію радіонуклідів.
10. Шляхи надходження радіонуклідів у водойми.
11. Шляхи надходження радіонуклідів у рослини.
12. Особливості некореневого надходження радіонуклідів в рослини.
13. Види вітрового підняття ґрунту.
14. Фактори, що впливають на перехід радіонуклідів з ґрунту в рослини.
15. Специфіка видів сільськогосподарських рослин щодо нагромадження
окремих радіонуклідів.
16. Особливості міграції радіонуклідів у лісних насадженнях.
17. Шляхи надходження радіонуклідів в організм тварин.
18. Коефіцієнти всмоктування та переходу радіонуклідів в продукцію
тваринництва.
19. Поняття про період піввиведення радіонукліду з організму.
20. Визначення поняття інкорпорованих радіонуклідів.
21. Специфіка нагромадження окремих радіонуклідів в тканинах та органах
рослин і тварин.
22. Підвищена небезпека дії окремих типів випромінювань інкорпорованих
радіонуклідів.
23. Причини тривалої дії на організм інкорпорованих радіонуклідів.
24. Фактори, що впливають на надходження і накопичення радіонуклідів в
рослини і організм тварин.
25. Специфіка прояву радіобіологічних ефектів при дії інкорпорованих
радіонуклідів на рослини.
26. Специфіка прояву радіобіологічних ефектів при дії інкорпорованих
радіонуклідів на організм тварин.
27. Причини локального накопичення у великих кількостях радіоактивного
йоду в організмі хребетних тварин.
28. Причини надзвичайної небезпеки надходження в організм ссавців
радіоактивного стронцію.
29. Особливості дії на організм гарячих частинок.
30. Дозиметрія інкорпорованих радіонуклідів.
Шрифти
Розмір шрифта
Колір тексту
Колір тла
Кернінг шрифтів
Видимість картинок
Інтервал між літерами
Висота рядка
Виділити посилання
Вирівнювання тексту
Ширина абзацу