10.3. МЕТОД ІЗОТОПНИХ ІНДИКАТОРІВ У ДОСЛІДЖЕННЯХ В ГАЛУЗІ БІОЛОГІЇ ТА ЕКОЛОГІЇ
| Сайт: | Навчально-інформаційний портал НУБіП України |
| Курс: | Сучасні проблеми радіобіології та радіоекології |
| Книга: | 10.3. МЕТОД ІЗОТОПНИХ ІНДИКАТОРІВ У ДОСЛІДЖЕННЯХ В ГАЛУЗІ БІОЛОГІЇ ТА ЕКОЛОГІЇ |
| Надруковано: | Гість-користувач |
| Дата: | четвер, 22 січня 2026, 12:24 |
Опис
План лекції
1. Визначення радіобіології та її місце серед суміжних наук.
2. Напрями розвитку радіобіології та її задачі.
3. Історія радіобіології: етапи розвитку.
4. Сучасні проблеми радіобіології та радіоекології.
5. Необхідність широкої пропаганди радіобіологічних знань.
Зміст
- 1. Суть методу
- 2. Мічені сполуки і добрива
- 3. Основні шляхи використання радіоактивних ізотопних індикаторів в дослідженнях з рослинами
- 4. Особливості застосування радіоактивних ізотопів у вегетаційних та польових дослідженнях
- 5. Радіоавтографія
- 6. Особливості використання стабільних ізотопів
- 7. Контрольні запитання до лекції 10.3
1. Суть методу
Одним з шляхів практичного використання досягнень ядерної фізики в різних галузях господарства і науки є використання методу ізотопних індикаторів, або, як ще його називають, методу мічених атомів.
Міченими атомами називають ізотопи, котрі, відрізняючись по масі від атому елемента, можуть використовуватись як мітка (індикатор) при вивченні найрізноманітніших процесів розподілу, переміщення і перетворення речовин у скільки завгодно складних системах, в тому числі і в живих організмах.
Як мітку - ізотопний індикатор використовують не тільки радіоактивні, а і стабільні ізотопи. Але при використанні радіоактивних ізотопів певне значення може мати біологічна дія їх іонізуючих випромінювань. Тому метод ізотопних індикаторів базується на двох положеннях:
- хімічні властивості різних ізотопів одного елемента практично однакові, завдяки чому їх поведінка в процесах, які вивчаються, не відрізняється від поведінки інших атомів того ж елементу;
- радіоактивні ізотопи у кількостях, що застосовуються у якості мітки, не чинять біологічної дії на живі організми.
Багато радіологів вважають, що метод ізотопних індикаторів не належить безпосередньо до кола інтересів радіобіології. І взагалі з цім можна погодитись. Але не можна не враховувати, що своїм народженням цей метод, як і радіобіологія, завдячує відкриттю явища радіоактивності, відкриттю саме радіоактивних ізотопів, котрі набагато частіше, ніж стабільні, використовуються як мітка.
Більш того, угорський хімік Д.Хевеші та німецький хімік Ф.Панет, які винайшли і запропонували цей метод в 1913 році, вперше застосували його саме в біологічних експериментах. І з того часу наука про дію іонізуючих випромінювань на живі організми і вчення про використання радіоактивних ізотопів в біології ідуть паралельно. Не випадково багато авторів, розглядаючи проблему використання досягнень ядерної фізики і радіобіології в сільському господарстві, поряд з радіаційно-біологічними технологіями як самостійний напрямок або окремий підхід виділяють використання методу ізотопних індикаторів в дослідницьких та прикладних роботах в галузі як рослинництва, так і тваринництва.

Саме тому знайдено доцільним включення глави про цей метод в підручник по радіобіології для агрономічних спеціальностей. Тим більше, що агроному-науковцю, особливо спеціалісту в галузі агрохімії, ґрунтознавства, захисту рослин, фізіології рослин нерідко приходиться використовувати його в своїй роботі для вирішення найрізноманітніших завдань. Не випадково саме з курсом "Застосування ізотопів в сільському господарстві” в свій час прийшла радіобіологія як дисципліна у вищий аграрний заклад освіти.
Але, звичайно, використання методу ізотопних індикаторів не обмежується інтересами радіобіології і навіть біології в цілому. Важко назвати напрямок в природничих науках і сферу в галузі господарства, де б він в наш час не застосовувався. Він використовується у медицині і медичній промисловості, хімії і хімічній промисловості, геології, фізиці, металургії, матеріалознавстві, археології. Широкого застосування метод набув у сільському господарстві для оцінки фізичних властивостей ґрунту і запасів в ньому елементів живлення, для вивчення взаємодії ґрунту та добрив, процесів засвоєння рослинами елементів живлення з ґрунту і добрив, позакореневого надходження в рослини елементів, для виявлення дії на рослинний організм пестицидів, вивчення особливостей обміну речовин сільськогосподарських рослин. Застосовуючи метод ізотопних індикаторів, досліджують найважливіші властивості польових і плодових рослин – ріст і розвиток, особливості окремих процесів обміну, стійкість до різних несприятливих факторів навколишнього середовища, продуктивність.
В тваринництві за допомогою цього методу вивчають фізіологічні процеси, що протікають в організмі тварин, проводять аналіз корму на вміст токсичних речовин, малі кількості яких важко, а іноді і неможливо визначити за допомогою інших методів, використовують його для вивчення міграції комах-шкідників сільськогосподарських рослин і переносників хвороб сільськогосподарських тварин, поведінки бджіл, оцінки рибних запасів місцевих водоймищ, а також в багатьох інших сферах сільськогосподарського виробництва.
Слід підкреслити, що чутливість методу ізотопних індикаторів, особливо це стосується використання радіоактивних ізотопів, надзвичайно висока. Вона на багато порядків перевищує чутливість хімічних та інших фізичних методів. Саме тому завдяки методу мічених атомів вдалося вирішити багато завдань, котрі принципово неможливо було вирішити за допомогою інших підходів.
В агрохімічних та фізіологічних дослідженнях найчастіше використовують такі ізотопи: стабільні – 2Н, 13С, 15N, 18О та радіоактивні (в дужках вказаний тип випромінювання та період піврозпаду) – 3Н (бета-, 12,26 року), 14С (бета-, 5730 років), 22Na (гамма-, 2,64 року), 32Р (бета-, 14,3 доби), 35S (бета-, 87 діб), 42К (бета-, гамма-, 12,5 год.), 45Са (бета-, 152 доби), 59Fe (бета-, гамма-, 45,1 доби), 60Со (бета-, гамма-, 5,27 року), 65Zn (гамма-, 250 діб), 86Rb (бета-, гамма-, 19,5 доби).
Так звану ізотопну сировину - речовину, що складається з чистого ізотопу, одержують шляхом послідовних складних операцій, які мають назву „ізотопного розділу” на спеціальних розподільних пристроях. З їх допомогою в наш час звичайно отримують стабільні ізотопи. Що стосується радіоактивних ізотопів, то їх одержують або шляхом опромінення нерадіоактивних речовин в атомних реакторах і прискорювачах заряджених частинок (по аналогії з 60Co для опромінюючих пристроїв, про що коротко розповідалось в попередньому розділі цієї глави), або шляхом хімічного виділення з суміші відходів ядерного палива (по аналогії з 137Cs ).
Мічені сполуки - це хімічні речовини, в яких атоми одного елемента, іноді декількох елементів, мають ізотопний склад, що відрізняється від природного. Мічені сполуки одержують за допомогою трьох основних методів: хімічного синтезу, ізотопного обміну (іноді їх об’єднують під загальною назвою – хімічний шлях) та біологічного синтезу (біологічний шлях).
Хімічний синтез, як правило. здійснюється за допомогою звичайних методів препаративної хімії. Але на певному етапі синтезу до складу реакційних компонентів замість звичайного елементу включається потрібний ізотоп.
Ізотопний обмін - це хімічний процес, який полягає в перерозподілі ізотопів якого-небудь елемента між реагуючими речовинами. При ізотопному обміні відбувається заміщення одного ізотопу елемента на інший в молекулі речовини без зміни їх елементарного складу. Наприклад: 42КСl + NaOH = 42KOH + NaCl
Мічені високомолекулярні сполуки біологічного походження, такі як нуклеїнові кислоти, білки, ферменти, деякі амінокислоти, гормони, вітаміни та інші, хімічний синтез яких ускладнений або не можливий і котрі не завжди вступають в реакції ізотопного обміну, отримують шляхом культивації різних організмів іn vivo або in vitro на середовищах, що містять ізотоп, або введення ізотопу в організм за допомогою яких-небудь інших методів, з наступним препаративним виділенням цих сполук. Таким способом далеко не завжди вдається отримати мічену сполуку з досить високим вмістом ізотопу (високою питомою активністю ізотопу), але нерідко цей шлях є єдиним можливим для отримання міченої речовини біологічного походження.
2. Мічені сполуки і добрива
Одним з головних завдані, не тільки агрохімії, але й агрономії в цілому є розробка раціональних заходів використання сільськогосподарськими рослинами елементів живлення. В зв'язку з цим виникає необхідність застосування прямих методів у вивченні використання рослинами внесених в грунт добрив. Це може бути здійснене тільки за допомогою мічених добрив.
Методи хімічного аналізу можуть дати лише загальні відомості про кількість елементів живлення в рослині або ґрунті. Метод ізотопних індикаторів дозволяє простежити долю конкретного елемента, що внесений з добривом або утилізований в ґрунті до його внесення. Він дозволяє кількісно просліджувати за надходженням, транспортом та засвоєнням певного елемента, оцінити швидкість йогo пересування по рослині, нагромадження в окремих органах з точністю, яка на 5-10 порядків перевищує точність хімічних аналізів. Саме тому в наш час метод ізотопних індикаторів набуває значення одного з основних методів агрофізіологічних досліджень.
При проведенні агрохімічних досліджень або робіт в області фізіології мінерального живлення рослин з використанням методу ізотопних індикаторів необхідно мати мічені добрива. Основними вимогами до якості міченого добрива, як і до будь-якої міченої сполуки, є такі: ізотоп-індикатор повинен перебувати у такій же хімічній формі, що і елемент живлення в складі добрива; він повинен бути рівномірно розподілений по всій масі добрива; кількість його повинна бути достатньою для визначення відповідними вимірювальними приладами, але не викликати будь-яких суттєвих відхилень у перебігу біологічних процесів.
У якості індикаторів в добривах використовують і стабіліні і радіоактивні ізотопи. Головною перевагою стабільних ізотопів є відсутність іонізуючих випромінювань. Однак, лише невелика кількість елементів мають придатні для агрофізіологічних досліджень стабільні ізотопи. Мала їх доступність, порівняно складна техніка виявлення і відносно низька чутливість складають головні недоліки методик з використанням стабільних ізотопів.
В цьому відношенні радіоактивні ізотопи мають такі незаперечні переваги: можливість їх отримання практично для всіх елементів періодичної системи, надзвичайно висока чутливість і точність визначення, відносна доступність вимірювальних приладів. Саме тому більшість досліджень із застосуванням методу ізотопних індикаторів проводиться саме з радіоактивними ізотопами.
Існують радіоактивні ізотопи і всіх без винятку елементів живлення. Однак з ізотопів-макроелементів вище означені переваги мають лише 32Р, 35S, 45Ca, а з ізотопів-мікроелементів – 59Fe, 60Co, 65Zn та деякі інші. Що стосується інших елементів, то невеликий період піврозпаду робить практично неможливим їх використання в довготривалому експерименті по вивченню, наприклад, транспорту елемента, його включення в метаболізм з точним кількісним підрахунком. Так, період піврозпаду найбільш довгоживучого радіоактивного ізотопу азоту 13N складає лише 10 хвилин. Радіоактивний ізотоп калію 40К має великий період піврозпаду - більше мільярда років, але дуже низьку радіоактивність і не може використовуватись для точних оцінок. Його штучний аналог ізотоп 42К має достатню радіоактивність, але короткий період піврозпаду – 12,4 години. Короткий період піврозпаду у радіоактивного ізотопу міді - 64Cu – 12,8 години, молібдену 99Мо - 67 годин, деяких інших мікроелементів. Ці ізотопи звичайно використовують лише у спеціальних короткочасних експериментах, наприклад, для вивчення окремих етапів їх надходження в рослини, швидкості всмоктування через корені, локалізації в листі при позакореневому внесенні та подібних.
Тому для отримання мічених азотних добрив застосовують стабільний ізотоп азоту 15N. Для вивчення транспорту та утилізації калію взагалі немає придатного стабільного або радіоактивного ізотопу і замість нього використовують штучний радіоактивний ізотоп рубідію 86Rb з періодом піврозпаду 19,5 діб - елемента, який звичайно зустрічається в природі як ізоморфна домішка в калії і вважається його близьким хімічним аналогом. Специфічна дія рубідію на рослини, як, між іншим, і на інші організми, на відміну від його аналогу натрію, невідома.
Існує два основних способи одержання мічених добрив. Перший з них передбачає введення мітки в добриво в процесі йогo отримання по заводській технології, Наприклад, розчин, що містить радіоактивний фосфат кальцію Са3(32РО4)2, нерадіоактивна сіль якого складає основу природних фосфатів (фосфориту і апатиту) або апатитового концентрату, додають до сірчаної кислоти, якою вони обробляються при отриманні звичайного простого суперфосфату, або до фосфорної кислоти - при отриманні подвійного суперфосфату.
Аналогічним шляхом можуть бути одержані мічені азотні і калійні добрива, коли в процесі виготовлення в залежності від хімічної основи добрива до них додають мічені солі (15NН4)2SO4, 15NH4Cl, 15NH4NO3 або її різновиди за місцем мітки: NH415NO3, 15NH415NO3, 86RbCl, 86Rb2SО4. Цей спосіб отримання мічених добрив найбільш досконалий, так як включення ізотопу в технологічний процес виробництва добрив дозволяє досягти рівномірного розподілу мітки по всій його масі. Але цілком очевидно, що цей спосіб досить дорогий, так як потребує створення в заводських умовах спеціальної технологічної лінії або її відтворення в конкретних експериментальних умовах.
Другий спосіб більш простий і тому частіше використовується в дослідницьких цілях. Він полягає в простому змішуванні розчину радіоактивної солі з водяною суспензією готового добрива в лабораторних умовах. Після цього суспензія висушується до вихідної вологості добрива. Цей спосіб є менш досконалим, але цілком придатним за умов, що досягається рівномірний розподіл мітки по всій масі добрива. У випадках, коли добриво, представлене простою сіллю (наприклад, аміачна селітра, хлористий калій) і змішується з такою ж сіллю, можна отримати мічене добриво, що не поступається за якістю виготовленому за першим способом.
Ще простіше готуються мічені рідкі поживні розчини і середовища для водяних та піщаних культур. В цьому випадку, у відповідності до складу поживної суміші, частина солі, яка повинна нести конкретну мітку, замінюється препаратом, що містить ізотоп.
Важливим моментом при приготуванні добрив або поживного розчину, мічених радіоактивним ізотопом, є вибір індикаторної дози ізотопу. З одного боку, вона повинна бути достатньо високою, щоб забезпечити точність в оцінці участі в метаболізмі рослини досліджуваного елемента. Але з другого, - не настільки високою, щоб спричинити радіаційну дію. При цьому слід враховувати, що не тільки інгібуюча дія ізотопу, але й стимулююча може викривити картину надходження і перетворення елемента. Необхідно також виключити можливий вилив випромінювання на експериментатора та радіоактивне забруднення навколишнього середовища у випадку проведення експерименту в польових умовах або в умовах вегетаційного будиночка.
Тому вибір індикаторної дози є важливим, хоча і складним завданням. При його вирішенні необхідно враховувати цілі і завдання експерименту, специфіку ізотопу та сполуки, до складу якої він входить, радіочутливість виду рослини, можливості вимірювальних приладів, умови проведення експерименту та інше. В дослідах з рослинами приблизний інтервал індикаторних доз, як правило, знаходиться в діапазоні 103-104 Бк/л(кг) поживного розчину, середовища або ґрунту. Індикаторні дози для досліджень з ссавцями з урахуванням їх, як правило, більш високої радіочутливості, приблизно на порядок нижчі.
При проведенні короткочасних дослідів, тривалість яких вимірюється годинами-днями, верхня межа індикаторних доз з метою збільшення чутливості методу може бути зміщена у бік більш високих концентрацій. Навпаки, у довготривалих експериментах, що продовжуються місяцями, наприклад, при внесенні мічених добрив в грунт, - в бік більш низьких концентрацій.
Оцінити індикаторну дозу розрахунковим шляхом – досить складне завдання, яке до того ж вирішується дуже орієнтовно. Тому в кожному конкретному випадку бажано ставити попередні контрольні досліди, які можуть допомогти визначити необхідну кількість радіоактивного ізотопу, що забезпечить оптимальні умови проведення експерименту як з точки зору одержання достовірних даних, так і радіаційної безпеки експериментатора.
3. Основні шляхи використання радіоактивних ізотопних індикаторів в дослідженнях з рослинами
За допомогою методу ізотопних індикаторів у біології рослин, зокрема фізіології, та агрохімії найчастіше вирішуються два основні завдання: дослідження транспорту і розподілу в рослині окремих елементів та вивчення ролі окремих речовин в метаболізмі.
Сформульовані в найзагальнішому вигляді, вони проте охоплюють практично всі можливі шляхи використання методу в рамках експериментальної біології рослини: шляхи надходження, транспорту та утилізації елементів живлення в рослині через корені та листя; дослідження просторового розподілу окремих елементів та речовин в рослині; вивчення впливу різних типів живлення рослин на обмін окремих речовин та дослідження участі в обміні окремих сполук; оцінка швидкості пересування речовин по рослині та багато інших.
Треба підкреслити, що введений в рослину мічений елемент залучається в метаболізм, в процесі якого з ним можуть відбуватися різні хімічні перетворення. Безперечно, кінетика надходження і розподілу елемента в значній мірі залежить від того, в якій формі він вводиться у рослину. Але в процесі включення в обмін речовин з ним можуть відбуватися певні метаболічні перетворення, внаслідок яких речовини "перемічуються", тобто мітка – ізотоп може потрапляти до складу зовсім інших сполук. Для ідентифікації того, в якій хімічній формі і до окладу якої сполуки включився мічений елемент, необхідно поєднувати метод ізотопних індикаторів з іншими фізіологічними, біохімічними, цитохімічними методами та засобами препаративного розділу і аналізу суміші речовин.
Дослідження транспорту та розподілу в рослинах окремих елементів. Кожний метод є логічним ланцюжком конкретних прийомів, які необхідно здійснювати при постановці та проведенні досліджень. Як типовий приклад такого завдання можна розглянути схему проведення експерименту з вивчення розподілу міченого елемента в рослині.
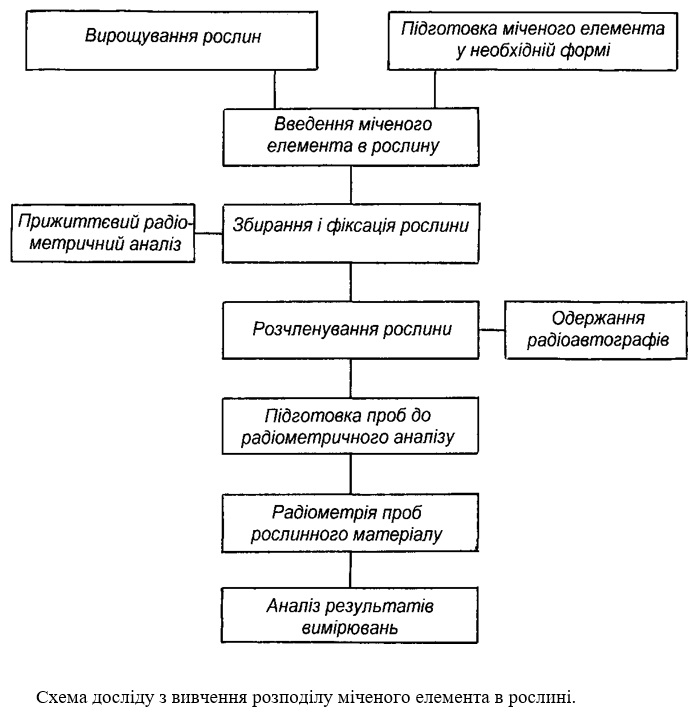
Дослід починається з вирощування рослини в умовах ґрунтової, піщаної або водяної культури до якого-небудь певного віку або фази, передбаченої його цілями і завданнями. По досягненні цього періоду готують розчин міченої сполуки з заданою питомою активністю. Частіше вводять мічений елемент в складі якої-небудь сполуки через кореневу систему. Якщо рослина вирощується в умовах ґрунтової або піщаної культури, то це проводять шляхом поверхневого поливу субстрату розчином, який містить мічену речовину, і підгрунтовим його введенням через дренажну трубку. В умовах ґрунтової культури для більш рівномірного розподілу розчини по посудині можна попередньо по колу гострим штирем зробити в ґрунті декілька наскрізних вертикальних отворів. Завдання введення і рівномірного розподілу мітки значно полегшується при проведенні досліду в умовах водяної культури. Іноді мічена сполука вводиться в субстрат ще при закладанні досліду перед посівом рослин. У цьому випадку вирішення питання рівномірного його розподілу по посудині також спрощується.
При позакореневому введенні ізотопу його нанесення звичайно проводиться двома шляхами: обприскуванням з пульверизатора або змочуванням поверхні листя. У випадку використання в майбутньому листя для аналізу з метою зняття з поверхні радіоактивних речовин їх відмивають водою і розчинами немічених солей, в фopмi яких вводилась мітка.
Існують і інші способи введення мітки в рослини. З них, в першу чергу, треба виділити ін'єкцію розчину ізотопу в провідну систему рослини за допомогою медичного шприца. Іноді використовують такі способи як поглинення розчину ізотопу "ґнотом" з листка, у якого відрізають бокові частини пластинки, а смужку, що залишилася з середньою жилкою („гніт”), занурюють в пробірку з ізотопом; всмоктування розчину з ізотопом через зріз черешка або пеньок бокового стебла; нанесення розчину з ізотопом на точку росту.
При роботі з радіоактивними ізотопами, для котрих розроблена розглянута схема, методика передбачає прижиттєве вивчення транспорту і розподілу міченої сполуки в рослині. Для цього використовують виносні детектори радіоактивності, виготовлені звичайно на основі малогабаритних газорозрядних лічильників Гейгера-Мюллера. За допомогою таких датчиків, підключених до радіометричної апаратури, можна реєструвати момент надходження мітки у той чи інший орган, оцінювати швидкість її пересування по стеблу і листку, а за ступенем радіоактивності визначити і місця локалізації. Зрозуміло, що таким шляхом можливо лише дуже приблизно виявити характер пересування ізотопу по рослині, а тим більше дати кількісну оцінку його розподілу. Але при вмілому використанні він може стати джерелом цінної, а іноді і зовсім унікальної інформації. Найбільш вдало даний засіб використовується в експериментах з великими рослинами - соняшником, кукурудзою, плодовими культурами, виноградом та іншими. В цьому випадку на рослині можна закріпити декілька датчиків і з досить високою точністю у перебігу онтогенезу рослини вивчати процеси транспорту та нагромадження міченої сполуки в різних її органах.
Для отримання більш змістовної картини розподілу міченого елементу по рослині або в окремому органі використовують метод радіоавтографії, про який буде сказано далі.
Але найбільш точну кількісну картину транспорту і локалізації в рослині міченого елемента можна одержати за допомогою радіометричного аналізу окремих частин і органів рослини. Для того на певних стадіях розвитку рослини чи їх частини фіксують. Фіксація - це штучне умертвіння рослини. Вона є дуже відповідальною операцією, яка повинна забезпечити по можливості досить швидке, щоб не допустити перерозподілу мітки після завершення експерименту, припинення обміну речовин.
Найбільш досконалим способом фіксації вважається занурення рослин або окремих органів в рідкий азот (-196 °С), що забезпечує практично миттєву зупинку метаболізму. Застосовують теплову фіксацію – прогрів рослин в термостаті при 105 °С, занурення в етиловий спирт, суміш спирту з оцтовою кислотою та деякі інші середовища. Але всі ці способи поступаються першому і при їх застосуванні характер розподілу мічених сполук може дещо змінюватися. Щоб звести до мінімуму ці порушення, рослини розчленовують на окремі органи, подрібнюють і якнайшвидше піддають висушуванню в термостаті. Потім проби змелюють до порошкоподібного стану і на радіометричному приладі оцінюють їх радіоактивність. Знання радіоактивності міченої сполуки, введеної в рослину, дає можливість розрахувати її кількість на орган і одиницю маси рослини.
Вивчення ролі окремих речовин в метаболізмі рослин. Коло питань, що вирішується попереднім дослідженням, може бути суттєво розширене за рахунок більш глибокого вивчення участі міченої сполуки в процесі метаболізму. Виділяючи з окремих органів рослин певні речовини і визначаючи в них вміст ізотопу, можна прослідкувати за метаболічними перетвореннями тої чи іншої сполуки. Саме таким шляхом були отримані за допомогою радіоактивних ізотопів унікальні відомості про особливості фосфорного, кальцієвого, сірчаного обміну в рослині, про фізіологічну роль багатьох мікроелементів, фундаментальні дині про перетворення окремих речовин та інші.
Застосування методу мічених атомів дозволило більш глибоко вирішити питання про роль вуглецю у фотосинтезі. Тільки з можливістю одержання міченого вуглекислого газу 14СО2 вдалося проникнути в таємниці зеленого листа, яке перетворює цю просту речовину у складні органічні сполуки. Цей шлях біосинтезу відомий під назвою циклу Кальвіна, або відновлювального пентозофосфатного циклу.
І В.В.Рачинський наводить схему досліду з вивчення хімічного перетворення вуглецю у фотосинтезі вже як типовий приклад вирішення задачі такого типу.
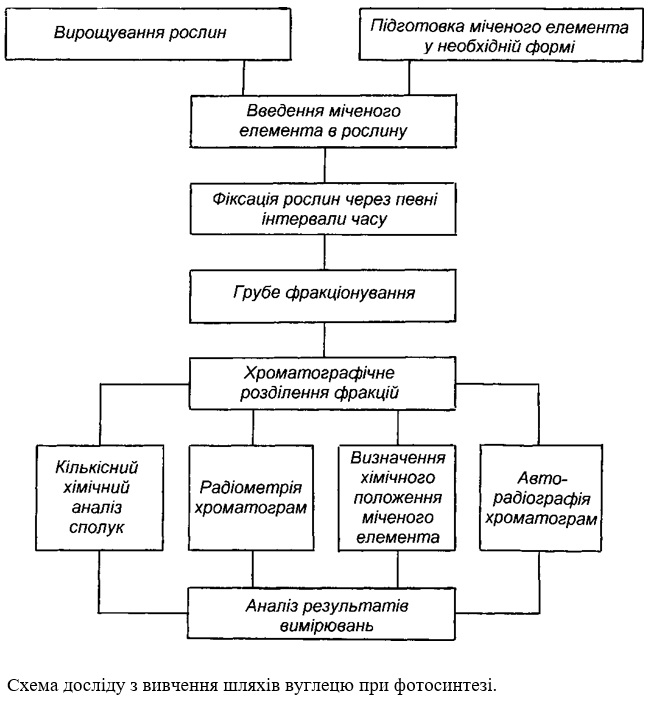
Згідно неї. підготовлену до досліду рослину разом з посудиною ставлять на певний час в камеру з міченим вуглекислим газом, який звичайно одержують шляхом додавання в пробірку зі злегка зволоженим міченим карбонатом барію (Ва14СО3) 30 %-ї хлорної кислоти. Невелика камера може бути створена для окремого листка. При цьому місце введення листка в камеру в зоні черешка, як і взагалі вся камера, повинно бути повітряно непроникним. У короткочасних дослідженнях з фотосинтезу можуть бути використані і зрізані з рослин окремі листки, черешки яких занурені в пробірки з водою, поживним розчином, а у випадку вирішення певних завдань і безпосередньо в розчин з міченим карбонатом. Після експозиції рослини фіксують і проводять групове фракціонування вуглецевмісних речовин, у перебігу якого виділяють, наприклад, амінокислоти, органічні кислоти, білки, вуглеводи, ліпіди та інші сполуки. Далі за допомогою методів аналітичної біохімії - хроматографії, електрофорезу та інших проводять розподіл цих речовий на індивідуальні хімічні сполуки і визначають їх радіоактивність.
В тому випадку, коли отримують паперові або тонкошарові хроматограми, електрофореграми з них можна зняти радіоавтографи (фотовідбитки), які відображають у повному смислі слова картину розподілу радіоактивного міченого елемента у складі різних сполук, тобто у які сполуки включився вуглець. Радіометричний їх аналіз дозволяє кількісно оцінити динаміку розподілу вуглецю. Саме такі підходи і дозволили вивчити і описати шляхи фіксації і перетворення вуглецю при фотосинтезі.
Подібні прийоми дають можливість вирішувати завдання, пов'язані з вивченням poлі в метаболізмі і більш складних сполук: окремих амінокислот, ферментів, фізіологічно активних речовин, нарешті, навіть таких складних утворень як нуклеїнові кислоти. Дуже ефективно використовується цей підхід в радіобіології для вивчення дії іонізуючих випромінювань на порушення окремих систем метаболізму, вияснення механізмів протирадіаційного захисту і післярадіаційного відновлення.
4. Особливості застосування радіоактивних ізотопів у вегетаційних та польових дослідженнях
Для вивчення надходження та транспорту окремих елементів в рослину використовують і звичайну техніку постановки вегетаційних дослідів. При цьому слід дотримуватись запобіжних заходів проти поширення радіоактивного забруднення, що в умовах вегетаційного досліду, а тим більш у полі, здійснити значно важче, ніж в лабораторії.
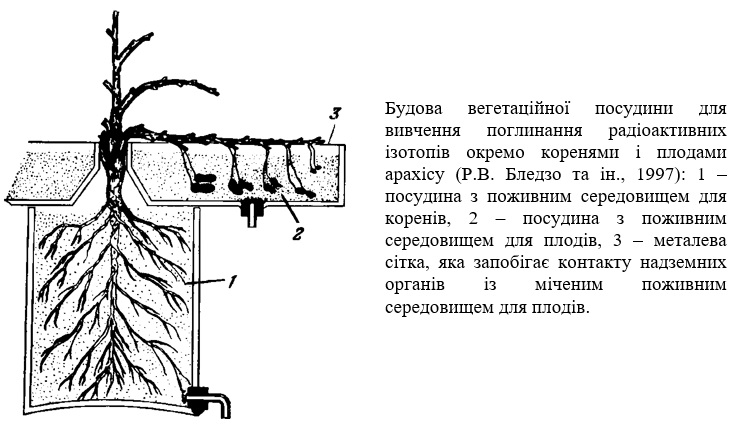
На рисунку для прикладу наведена схема двокомпонентної вегетаційної посудини, яка використовується для вивчення надходження елементів живлення в різні органи рослин арахісу. Корені рослини розміщені у 15-літровій посудині, а плодоносні органи, які ростуть також у ґрунті, в окремій чашці. Кожна зона рослини може отримувати елементи живлення окремо. За таких умов легко прослідкувати долю будь-якого міченого елементу, що вводиться в рослину тим чи іншим шляхом, в тому числі і через надземні органи, його поглинання, транспорт і розподіл в коренях, листках, плодах. Саме у подібних дослідах з радіоактивними ізотопами була доведена більш висока ефективність підживлення рослин через листя у порівнянні з іншими видами підживлення такими елементами як фосфор, калій і сірка, які швидко поглинаються листям і рухаються по флоемі до інших органів. Водночас було показано, що кальцій, магній, залізо, мідь легко поглинаються листками, але пересуваються з них повільно і на незначні відстані.
Особливості поглинання елементів живлення рослинам з добрив за допомогою методу ізотопних індикаторів можуть бути добре вивчені в польових умовах, тобто максимально наближених до природних умов вирощування рослин. В цьому випадку важливим завданням є внесення в грунт мічених добрив, виготовлених за будь-яким з вищеописаних способів. В дослідах з однорічними рослинами мічене добриво, як і звичайне, може вноситись перед посівом (посадкою) при ретельному перемішуванні його з ґрунтом. В експериментах з багаторічними рослинами або внесенні мічених добрив під вегетуючу однорічну рослину, наприклад, в період формування продуктивних органів, використовують два способи внесення - поверхневий та глибинний.
Прийоми внесення мічених добрив в польових умовах під рослини винограду, описані американським дослідником А.Ульріхом, прийнято вважати типовими. За його методикою при поверхневому внесенні навколо виноградної лози влаштовують з ґрунту грядку або лунку зі стороною квадрату або діаметром 120 см. Спочатку для зволоження в грядку вливають 40 л води, а потім 20 л води з розчиненим міченим добривом. Після того, як розчин просочить грунт, додають ще 100 л води для більш рівномірного його розподілу в зоні кореневої системи.
При глибинному внесенні мічених добрив в кожному кутку квадратної грядки або лунки (якщо лунка кругла, то в місцях перетину з окружністю двох взаємно перпендикулярних її діаметрів) просвердлюють отвори діаметром 4 см і глибиною 40 см. Всю дозу добрива розчиняють у 600 мл води і розподіляють порівну по чотирьох отворах навкруг лози. Зараз же після цього під кожну лозу вносять по 150 л води.
Описані методики з урахуванням видової специфіки, фази розвитку чи віку придатні для внесення мічених добрив під вегетуючі однорічні рослини, під плодові культури та інші.
Іноді для глибинного внесення мічених добрив під вегетуючі рослини використовують спеціальні зонди, що діють за принципом шприца. Такий зонд являє собою досить тонку, щоб не пошкодити кореневу систему, загострену на кінці сталеву трубку звичайно діаметром близько 10 мм і довжиною, що забезпечує внесення добрива на необхідну глибину, оснащену поршнем або іншим механізмом впорскування розчину.
Дуже важливим при проведенні польових дослідів з радіоактивними ізотопами є дотримання мір радіаційної безпеки для запобігання забруднення ділянки. Досліди в польових умовах украй бажано проводити з коротко- та середньоживучими ізотопами, наприклад, застосовувати 89Sr замість 90Sr, 134Сs замість 137Сs.
На відміну від лабораторних досліджень з ізотопами, працюючи в умовах вегетаційного або польового експерименту з десятками, сотнями або й тисячами рослин, вносячи мічені сполуки в різні фази їх розвитку, проводячи відбір проб і оцінку радіоактивності протягом всього вегетаційного періоду, можна дослідити особливості динаміка надходження, розподілу та нагромадження мічених сполук в окремих органах в ході онтогенезу і визначити вплив найрізноманітніших факторів на ці процеси.
Саме у вегетаційних та польових дослідженнях з міченими добривами та іншими сполуками вдалося оцінити ефективність використання різних елементів живлення добрив в залежності від їх форми, способу внесення, типу ґрунту, видових особливостей рослин; встановити справжні швидкості рухливості різних елементів живлення, фізіологічно активних речовин та інших сполук в залежності від способу внесення; виявити особливості поглинання рослинами елементів живлення з різних типів добрив та багато іншого.
Безумовно, в умовах вегетаційних та польових досліджень з радіоактивними ізотопами можна вирішувати і завдання, пов'язані з перетвореннями у процесі метаболізму різних речовин, які були описані вище. Більше того, в цих умовах, як уже відзначалося, наближених до природних, одержувані результати будуть більш близькі до реальних.
5. Радіоавтографія
Надзвичайно важливою перевагою радіоактивних ізотопів у порівнянні зі стабільними є їх властивість залишати, аналогічно видимому світлу, слід на фотоматеріалах. Ця їх здатність широко використовується для вивчення локалізації мічених сполук в окремих органах за допомогою методу радіоавтографії.
Радіоавтографія, або авторадіографія. - це спосіб вивчення розподілу радіоактивних речовин в досліджуваному об'єкті шляхом накладання на нього чутливих до іонізуючих випромінювань фотоматеріалів. Радіоактивні речовини, що містяться в об'єкті, начебто самі себе при цьому фотографують, завдяки чому і виникла назва методу. Фактично, саме за допомогою радіоавтографії А.Беккерель відкрив явище радіоактивності.
Суть фотографічного методу виявлення радіоактивності полягає в тому, що іонізуюче випромінювання, проходячи через фотоемульсію, взаємодіє з мікрокристалами галогенідів срібла - „зернами”, які входять до її складу. При цьому відбувається відновлення іонів срібла до нейтральних атомів, внаслідок чого утворюється так зване приховане зображення. Після проявлення і фіксації на шарі фотоемульсії в тих місцях, куди потрапило іонізуюче випромінювання, з'являються темні плями. Ділянки, на які потрапила більша кількість частинок або квантів, будуть більш темними, ніж ті куди їх потрапило менше.
Як і в світловій фотографії, під впливом іонізуючого випромінювання на звичайних фотоматеріалах утворюється негативне зображення. Якщо на його основі одержати позитивний відбиток, то можна побачити, що найбільш світлі місця відповідають найбільшій інтенсивності випромінювання, менш світлі - меншій інтенсивності, а темні - його відсутності. Таким чином, за ступенем засвічування фотоматеріалів можна судити про інтенсивність випромінювання і, відповідно, про кількість радіоактивної речовини, що міститься в будь-якій ділянці досліджуваного об’єкту.
Радіоавтограф, або авторадіограма, - це фотографічне зображення розподілу радіоактивних речовин в досліджуваному об'єкті, яке одержане за допомогою методу радіоавтографії.
Ряд переваг радіоавтографії робить її унікальним методом просторово-кількісного аналізу, котрий широко застосовується в багатьох галузях природничих наук, їх прикладних сферах, а особливо в біології та медицині. Досить широко використовується вона і в дослідженнях з рослинами.
До головних переваг методу радіоавтографії слід віднести такі: можливість одержання просторової картини розподілу радіоактивної речовини, в тому числі і спеціально введеного радіоактивного ізотопу, в досліджуваному зразку; високу чутливість методу, основану на властивості певних фотоматеріалів реєструвати окремі частинки і кванти, що дає можливість виявити в зразку такі малі кількості радіоактивних речовин, які не можуть бути виявлені за допомогою лічильників радіоактивності; можливість кількісної оцінки нагромадження речовини в різних ділянках досліджуваного об'єкту; можливість оцінки радіоактивності, а іноді і кількісного її визначення в дуже малих зразках, що порівнюються з розмірами дрібних кристаліті галогенідів срібла (десяті і соті долі мікрометра); одержання об'єктивного документа, що фіксує всі результат» досліду - радіоавтографа.
Як реєструючи середовища в радіоавтографії звичайно використовуються фотографічні емульсії. Хоча в принципі з цією метою можуть бути використані будь-які фотоматеріали, в яких під впливом іонізуючих частинок або квантів змінюється колір або його інтенсивність і які мають досить високу чутливість до випромінювань. Однак, чисельні дослідження показали, що найбільш зручний матеріалом є саме фотографічні емульсії. У порівнянні з іншими світлочутливими середовищами вони мають низку поки неперевершених переваг, що робить їх незамінними. Головна з них полягає в тому, що фотоемульсія здатна безперервно реєструвати радіоактивні розпади атомів, що дозволяє оцінювати їх сумарну кількість за час експозиції препарату. Цe стає можливим тому, що вона протягом тижнів і місяців зберігає постійними свої фізичні властивості. Користуючись цією особливістю емульсії, можна різко зменшити кількість радіоактивного препарату, який вводиться в рослину, що іноді буває дуже важливим. Суттєвою перевагою емульсії є можливість з її допомогою локалізувати радіоактивні розпади в просторі та підрахувати їх кількість. Не можна не враховувати і порівняну дешевизну цього матеріалу, фізичні властивості якого можна легко регулювати, змінюючи розмір мікрокристалів галогенідів срібла – зерен.
Виділяють дві основні різновидності радіоавтографії – макрорадіоавтографію і мікрорадіоавтографію. В основі обох лежить принцип контактної радіоавтографії, при якому об’єкт дослідження безпосередньо контактує з фотоматеріалом, на відміну від слідової, яка звичайно використовується у ядерній фізиці.
Макрорадіоавтографія має справу з великими об’єктами – цілими рослинами, окремими органами – листками, квітками, зрізами плодів та іншими. При цьому фотоплівка або фотопластинка прикладається до рівної поверхні зразка і притискується пресом. Після експонування і проявлення радіоавтограф аналізується в прохідному світлі шляхом порівняння густини почорніння фотоматеріалу.
Об’єктами мікрорадіоавтографії є мікроскопічні препарати – зрізи, давлені препарати, мазки та інші. При цьому розплавлена рідка фотоемульсія безпосередньо наноситься на зразок, утворюючи при застиганні щільно прилягаючий до зразка шар. Після експонування та проявлення радіоавтограф разом з об'єктом досліджується під оптичним або електронним мікроскопом у відбитому, а у випадку прозорості об'єкту і в прохідному світлі. Аналіз полягає у підрахунку слідів, що утворилися іонізуючими частинками у фотоемульсії на фоні різних тканинних та клітинних структур.
Безперечно, другий метод має значно більш високі розділяючи можливості, ніж перший. Якщо для одержання макрорадіоавтографів використовують фотоматеріали з великими мікрокристалами - зернами розміром 0,2-0,5 мкм (звичайні aбo рентгенівські фотопластинки або фотоплівки), то для отримання мікрорадіоавтографів застосовують особливі дрібнозернисті ядерні фотоемульсії з зернами розміром 0,01-0,02 мкм.
Для одержання радіоавтографів в рослину тим чи іншим способом, але частіше все ж таки через кореневу систему, разом з поживним середовищем вводять речовину, яка містить радіоактивний ізотоп. Для отримання макрорадіоавтографів через деякий час (години-доби), що визначається завданням та метою досліджень, зрізують окремі листки або інші органи чи беруть все рослину цілком, кладуть на фільтрувальний папір, розправляють як для гербарію і зверху також накривають фільтрувальним папером. Підготовлений таким чином об'єкт розміщують між двома рівними металевими пластинками і під пресом кладуть в сушильну шафу при температурі 80-85 0C. Після повного висушування в фотографічній кімнаті при слабкому темно-червоному або спеціальному жовто-зеленому світлі на нього накладають фотоплівку або фотопластинку, накривають м'якою тканиною і знову під пресом кладуть в світлонепроникну камеру або спеціальну касету. Остання операція повинна забезпечити максимально можливий контакт рослини з фотоемульсією.
Експонування, тривалість якого залежите від багатьох факторів, але головним чином визначається кількістю радіоактивної речовини, що надійшла в рослину, і оцінюється експериментально, складає звичайно доби-тижні, але може досягати і місяці. Після проявлення одержують макрорадіоавтограф, щ характеризує розподіл інкорпорованого радіоактивного ізотопу в рослині. При необхідності з отриманого негативу можна виготовити позитивний відбиток на фотопапері.
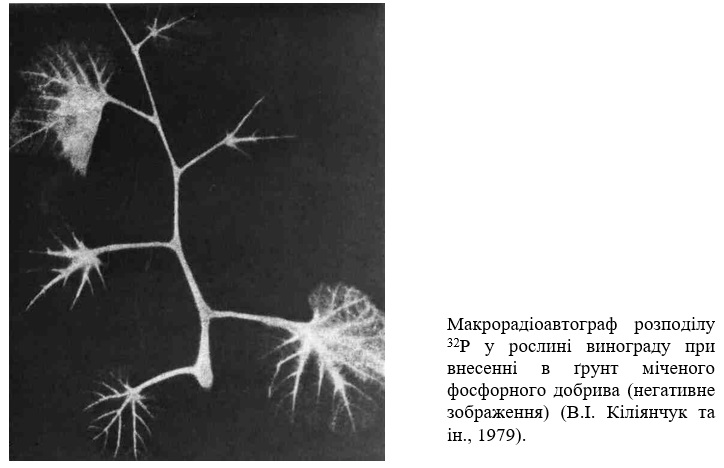
Нерідко виникає потреба одержати макрорадіоавтограф зі свіжої ще вологої росини (наприклад, при роботі з короткоживучими ізотопами). В цьому випадку зразок обкладають водонепроникною прокладкою із полімерної плівки тоді розміщують на поверхні фотоматеріалу. Можна, навпаки, загорнути фотоплівку. Головне при цьому - не допустити попадання вологи на фотоемульсію, особливо у місці її контакту з рослиною, так як навіть незначна кількість вологи може викликати при експонуванні дифузію галогенідів срібла із фотошару в зразок і викривити картину радіоавтографа.
Для мікрорадіоавтографії звичайно використовують фіксовані препарати окремих органів або тканин рослини, в яку введений paдіоактивний ізотоп, виготовлені за загальноприйнятими методиками цитології та гістології. На висушені препарати наносять фотоемульсію, експонують, проявляють і одержують мікрорадіоавтографи, на яких під мікроскопом можна виявити потемніння певних ділянок у вигляді окремих точок, розмір яких визначається розміром зерен срібла, утворених ними скупчень.
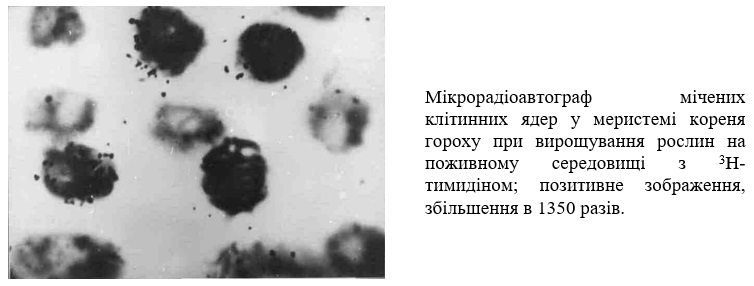
Метод радіоавтографії дозволяє не тільки виявляти локалізацію міченої сполуки в рослині, тканині або клітині, але й оцінити її кількість, оскільки кількість зерен відновленого срібла емульсії прямо пропорційна інтенсивності діючого на нього випромінювання. Кількісний аналіз макрорадіоавтографів проводять за допомогою звичайних методів фотометрії, а мікрорадіоавтографів - підрахунком під мікроскопом зерен, що приходяться на одиницю площі або окрему структуру, наприклад, ядро, хромосому. В останні роки для цих цілей успішно використовуються автоматизовані методи кількісної цитофотометрії.
Можливості застосування методу радіоавтографії до кінця ще не вичерпані. З відкриттям нових фотоматеріалів, винайденням нових приладів у поєднанні з новими методичними підходами аналітичної хімії та біохімії, цитології і гістології сфера його застосування в найрізноманітніших областях біології з кожним роком розширюється.
6. Особливості використання стабільних ізотопів
З зв'язку зі значно нижчою чутливістю методу можливості застосування в ролі мітки стабільних ізотопів в агробіологічних дослідженнях, як, до речі, і в багатьох інших, більш обмежені у порівнянні з радіоактивними ізотопами. Проте, стабільні ізотопи як індикатори можна застосовувати для вирішення практично всіх завдань, в яких використовуються радіоактивні ізотопи, хоча, як правило, з меншим успіхом і точністю.
Початкові стадії методик із застосуванням стабільних ізотопів не відрізняються від тих, де використовуються радіоактивні ізотопи. Специфіка методу проявляється лише на заключних етапах кількісного аналізу проб. Цей аналіз проводять на мас-спектрометрах - приладах, які призначені для розділення речовини за масами атомів і молекул. Принцип роботи мас-спектрометра оснований на дії магнітних і електричних полів на іонізовані пучки частинок у вакуумі з наступним їх сортуванням за атомними масами.
Із згаданих на початку підрозділу стабільних ізотопів найбільш широко використовуваним в агрофізіологічних та агрохімічних дослідженнях є ізотоп азоту 15N. Роботи з ним ведуться за такими основними напрямками: вивчення швидкості поглинання рослинами вільного азоту та азоту, що входять до складу різних азотистих сполук, в тому числі і добрив; визначення здатності до фіксації атмосферного азоту у різних видів рослин та вивчення швидкості процесів обміну азотистих сполук в рослинах.
В галузі агрохімії і ґрунтознавства використання 15N сприяло значному поширенню і поглибленню уявлень про трансформацію в ґрунті азоту самого ґрунту та азоту добрив, які в нього вносяться, зокрема, про суть процесів мобілізації та іммобілізації ґрунтового азоту, роль окремих видів мікроорганізмів при цьому. Застосування 15N в дослідах по живленню і обміну речовин в рослинах сприяло відкриттям, які дозволили проникнути в суть механізму початкових процесів засвоєння азоту і з'ясувати важливі сторони взаємодії між азотним живленням, фотосинтезом, забезпеченістю рослин іншими мінеральними елементами.
При цьому переваги прийомів і методів дослідження азоту на основі ізотопу 15N у порівнянні зі звичайними хімічними та агрохімічними настільки очевидні і загальновідомі, що важко зрозуміти, чому до тепер так обмежено використовуються. Відомий спеціаліст в галузі використання цього ізотопу при роботі з рослинами американський агрохімік Р.Мак-Вікар відмічає, що головна причина цього полягає в утрудненості визначення вмісту 15N в будь-якому об'єкті, так як з цією метою доводися вимірювати співвідношення молекулярних мас 15N і 14N на дорогих і складних в експлуатації приладах – згаданих мас-спектрометрах.
В чому ж полягають особливості застосування стабільних ізотопів, зокрема ізотопу 15N, у порівнянні з радіоактивними?
Відомо, що природний азот складається з двох стабільних ізотопів – 14N (99,63 %) та 15N (0,37 %). Живі організми не проявляють вибірковості у відношенні їх асиміляції, завдяки чому 15N може бути застосований в сполуках, що містять його до 60 %. Ступінь збагачення міченої сполуки ізотопом 15N характеризується величиною, яка являє собою різницю (в атомних процентах) між вмістом 15N в цій міченій сполуці та його вмістом в природній суміші ізотопів азоту. Цю величину називають надлишком атомного проценту 15N. Так, наприклад, якщо вміст 15N у якій-небудь міченій сполуці дорівнюватиме 0,48 %, то надлишок атомного проценту складе 0,48 - 0,37 = 0,11.
Мас-спектрометричному аналізу піддають аналізу суміш ізотопів у газоподібному стані. Для цього досліджуваний матеріал спалюють за загально відомим методом Кьєльдаля, а одержаний із сірчанокислого амонію аміак окислюють у вакуумі гіпобромітом до вільного азоту. Найменший надлишок атомного проценту, який можна виявити в пробі, складає 0,01-0,02, що відповідає приблизно 0,1-0,2 мкг 15N в 1 мл азоту за нормальних умов. Це досить висока точність.
І все ж таки, чутливість методу ізотопних індикаторів з використанням стабільних ізотопів не йде ні в які порівняння з чутливістю методу з використанням радіоактивних ізотопів. Якщо для першого межа точності оцінки вмісту ізотопу в зразках складає 10-4-10-6 %, то за допомогою другого можна фіксувати випромінювання ізотопу при кількості його в пробі в залежності від типу ізотопу 10-11-10-19%. Тому не дивно, що при можливості вибору дослідники завжди віддають перевагу методу радіоактивних ізотопів. На превеликий жаль, у випадку з азотом такого вибору немає.
В цілому ж з усією впевненістю можна констатувати, що завдяки широкому застосуванню методу ізотопних індикаторів як з використанням радіоактивних, так і стабільних ізотопів за останні десятиліття докорінно змінився експериментальний рівень багатьох біологічних дисциплін. Метод надзвичайно прискорив і поглибив процес пізнання основних закономірностей життя. Саме завдяки йому отримали потужній поштовх до розвитку такі області біологічної науки, як молекулярна і клітинна біологія, молекулярна генетика, клітинна інженерія, біохімія, фізіологія та багато інших.
В радіобіології мічені атоми давно стали ефективним інструментом для вирішення багатьох важливих проблем. За допомогою ізотопів вивчаються порушення процесів метаболізму при радіаційному ураженні та променевій хвороби, закономірності кінетики клітин в уражених критичних органах, механізмі дії різних радіомодифікуючих агентів, хід процесів післярадіаційного відновлення та багато інших.
Але цілком впевнено можна сказати, що і зараз далеко не досягнуті, а часом ще і не визначені межі застосування методу ізотопних індикаторів. Йому, особливо у поєднанні з іншими прийомами і методами, підкоряються все нові й нові області досліджень. Унікальним і чудовим методом озброїла ядерна фізика біологів.
7. Контрольні запитання до лекції 10.3
1. Поняття мічених атомів. Стабільні та радіоактивні ізотопи. Приклади.
2. Способи одержання мічених добрив. Вимоги до їх якості.
3. Основні шляхи використання методу мічених атомів в дослідженнях з
рослинами.
4. Суть методу радіоавтографії і його переваги в порівнянні з іншими
способами застосування методу ізотопних індикаторів.
5. Застосування ізотопу 15N для вивчення азотного обміну в рослинах.
Шрифти
Розмір шрифта
Колір тексту
Колір тла
Кернінг шрифтів
Видимість картинок
Інтервал між літерами
Висота рядка
Виділити посилання
Вирівнювання тексту
Ширина абзацу