Лекція 4. Сучасні методи дослідження стану навколишнього середовища (2 год)
| Сайт: | Навчально-інформаційний портал НУБіП України |
| Курс: | Методи вимірювання параметрів навколишнього середовища ☑️ |
| Книга: | Лекція 4. Сучасні методи дослідження стану навколишнього середовища (2 год) |
| Надруковано: | Гість-користувач |
| Дата: | четвер, 22 січня 2026, 19:09 |
1. Якісний аналіз стану довкілля
Екологічні дослідження стану довкілля мають свої особливості. Елементи і функції природного середовища досить складні, різноманітні і тісно взаємозв’язані між собою. Ця характеристика повністю передається і на методи та способи його дослідження. Перш за все це пов’язано з різною структурою досліджуваних середовищ довкілля: газоподібна повітряна атмосфера, тверда літосфера, рідинна гідросфера.
При екологічно-санітарних дослідженнях довкілля досить часто вивчаються фізичні (температура, тиск, прозорість, швидкість тощо), хімічні (якісний та кількісний елементарний та речовинний склад), біологічні (популяції, сукцесії тощо) параметри. Всі ці фактори (параметри) досить часто пов’язані між собою і тому дослідження лише одного елемента може ґрунтуватись на дослідженні (вимірюванні) інших. Якісний і кількісний аналіз забруднення середовищ довкілля є одним з найважливіших елементів екологічного моніторингу.
Під час дослідження стану довкілля кількісному визначенню часто передує якісний аналіз на наявність того чи іншого хімічного елемента, йона, сполуки. Якісний аналіз проводиться хімічними і фізичними методами.
При проведенні аналізу хімічними методами використовують хімічні реакції. Аналізовані речовини можуть бути в твердому, рідкому і газоподібному агрегатному станах. Реакції, які використовуються в якісному аналізі, мають супроводжуватися візуальним ефектом:
- появою чи зникненням осаду;
- появою, зникненням чи зміною кольору розчину;
- виділенням газів;
- утворенням кристалів характерного кольору і форми;
- появою забарвлених перлів;
- забарвленням полум'я;
- появою світіння;
- виникненням характерного забарвлення при розтиранні речовин.
Ще у XIX столітті патер Ф. Денца визначав озон в атмосферному повітрі впродовж 26 років, розвішуючи на подвір'ї папірці, змочені розчином йодиду калію; за ступенем їх побуріння внаслідок виділення йоду отримував інформацію про приблизний вміст озону.
Газовидільні реакції проводять у мікрогазових камерах або пробірках, вносячи туди краплину реагенту чи реактивний папір (фільтрувальний папір, оброблений відповідним реагентом), змочений водою. Газ, що виділяється, вступає в хімічні реакції, що супроводжуються появою характерного кольору сполуки.
При сплавлянні кристалічних солей з бурою Nа2В4О7*10Н2О чи фосфатом натрію на платиновій петлі в полум'ї газового пальника утворюються прозорі забарвлені "перли" характерного кольору: купруму і хрому – зелені, кобальту – блакитні, феруму і ніколю – жовті, мангану – фіолетові, стибію (сурми) – безбарвні.
Попередній висновок про наявність певного хімічного елемента можна зробити і на підставі забарвлення ним полум'я пальника (пробу сухої речовини чи розчин наносять на ніхромовий дротик у формі кільця, змочений попередньо розчином хлоридної кислоти і прожарений у полум'ї).
Літій, кальцій і стронцій забарвлюють полум'я в коричнево-червоний колір, натрій – у жовтий, калій – у фіолетовий, купрум, бісмут, бор, барій – в зелений, стибій – у блакитний.
При розтиранні аналізованої проби з сухим реагентом на фарфоровій пластинці чи папері (іноді в присутності гідросульфату калію КНSO4) відбуваються характерні реакції, що супроводжуються зміною забарвлення. Ці реакції часто використовують при встановленні типу мінералу.
У фізичних методах якісного аналізу використовують спостереження фізичних властивостей аналізованої речовини. Спектральні методи аналізу ґрунтуються на знятті спектрів поглинання або випускання речовини. В люмінесцентних методах речовини виявляють за здатністю світитись в ультрафіолетових променях. Для збудження люмінесценції необхідна ртутна лампа чи лампа розжарювання. Це чутливий метод. Зокрема, при взаємодії з 8-оксихіноліном Li+ дає блакитну люмінесценцію, Аg+ і К+ – жовто-зелену, А13+ – зелену, Мg2+ з люмомагнезоном – рожеву, Рb2+ з піридином і йодидом калію – жовто-коричневу, Сd2+ – блакитну. Виявлення речовин можливе також полярографічним шляхом, за електрохімічними явищами, які виникають у розчинах.
Елементи якісного аналізу досить ґрунтовно розглядаються в аналітичній хімії.
2. Методи розділення та концентрування складних речовин
Доцільно відмітити, що в хімічному аналізі широко застосовують різні методи розділення складних сумішей речовин та концентрування речовин, які передують проведенню аналізу. Для цього використовують, наприклад, перегонку, маскування йонів і дрібне осадження, хроматографію, екстракцію, адсорбцію тощо.
Маскування звичайно проводять зв’язуванням заважаючи йонів у комплексні сполуки – флуоридні (Fe3+, Al3+), хлоридні (Ag+ , Fe3+, Mn2+), тіоціанатні, аміачні, тартратні і деякі інші. Реагент, який застосовують для аналізу, повинен утворювати із досліджуваною речовиною значно міцнішу сполуку, ніж маскуючий реагент.
Видалення заважаючих йонів в осад. Заважаючи йони осаджують у вигляді карбонатів, гідроксидів, сульфідів, фосфатів, хроматів. Для цього підбирають осаджувач для утворення осаду із малим значенням добутку розчинності (менше 10-10 -10-12).
Екстракція органічними розчинниками. Застосовується для видалення, головним чином, речовин здатних до комплексоутворення. Частіше за все використовують екстракцію хлоридних, дитизонатних, оксіхінолятних комплексів. Нейтральні комплекси багатьох метал-йонів добре розчинні в органічних розчинниках. Це дозволяє видалити заважаючі йони, якщо додати необхідний комплексоутворювач і органічний розчинник, який не змішується з водою (наприклад, хлороформ). Комплекс, який утворюється, переходить в органічний розчинник і видаляється із водної фази.
Окиснення і відновлення речовин. Ці реакції використовуються в тих випадках, коли заважаючи йони здатні окислюватися або відновлюватися. Таким способом, наприклад, видаляють Сr 3+ (окиснення до СrO42-), Mn2+ (окиснення до MnO4- ), Ві2+ (відновлення до Ві0 ) та інші йони.
Адсорбція. Адсорбцією називають поглинання речовин із газового або рідкого середовища поверхневим шаром твердого тіла – адсорбенту. Адсорбцію відрізняють від абсорбції – поглинання речовин усім об’ємом абсорбенту, наприклад, поглинання аміаку водою. При молекулярній адсорбції речовина приєднується до поверхні адсорбенту завдяки:
а) електростатичного (диполь-дипольного або йон-дипольного) притягання молекул речовин до заряджених ділянок поверхні адсорбенту;
б) за допомогою водневих зв’язків.
При хемосорбції речовина вступає в хімічну реакцію з поверхнею адсорбенту. Частіше всього це – реакція обміну йонами між адсорбентом і розчином – так звана йонообмінна адсорбція.
Екстракція. Вибіркове розчинення окремих компонентів суміші речовин в будь-якому розчиннику називають екстракцією. Розрізняють екстракцію в системі тверда речовина – рідина (із твердих тіл) і в системі рідина – рідина (із розчинів речовин). Екстракція із твердих тіл. Застосовують для вибіркового розчинення одного або кількох компонентів твердих матеріалів (руд, сплавів, рослинної сировини). Твердий матеріал попередньо підсушують (якщо необхідно), подрібнюють і вводять в контакт із розчинником, який найбільше підходить – екстрагентом. Екстрагент проводить вибіркове розчинення певних компонентів матеріалу. Потім відокремлюють отриманий розчин компонентів – екстрат, і проводять його аналіз. Для отримання правильних результатів аналізу необхідно, щоб екстрагент повністю проекстрагував досліджувані речовини.
Екстракцію проводять екстрагентами, які добре розчиняють певні речовини. Для екстракції мінеральних речовин застосовують воду, розчини кислот або лугів, здійснюючи при цьому переведення мінеральних речовин у розчинну форму.
Рідинна екстракція. Застосовують для вибіркового вилучення речовин із водних розчинів за допомогою органічного розчинника, який не змішується з водою (хлороформ СНСl3, бензол С6Н6 та інші). Використовують два види рідинної екстракції – з хімічною реакцією і без неї. У першому випадку водний розчин речовин обробляють будь-яким реагентом, отримуючи сполуки, які добре розчинні в органічних розчинниках. Частіше за все для цього використовують добування комплексних сполук (хелатів), добре розчинних в органічних розчинниках. Такими властивостями володіють, наприклад, оксихіноляти, дитізонати, тіоціанати катіонів металів. При екстракції без хімічної реакції використовують здатність деяких речовин розчинятись у воді і органічних розчинниках (СН3СООН, Н2SO4, FeCl3, фенол та інші).
Якщо екстракції підлягають декілька речовин, то внаслідок різної їхньої здатності до розподілу між фазами проходить їх часткове розділення. Таким чином, застосовуючи рідинну екстракцію, можна розділити речовини. Часто для збільшення повноти розділення використовують багатоступінчасту екстракцію, для чого добутий екстракт (наприклад, Н2SO4 і НСООН) вводять у новий контакт з водою, екстрагуючи із органічної фази у водну частину речовин і т. д. При цьому розділення покращується. Для проведення рідинної екстракції звичайно використовують ділильні лійки або спеціальні апарати. Процес ведуть при помішуванні
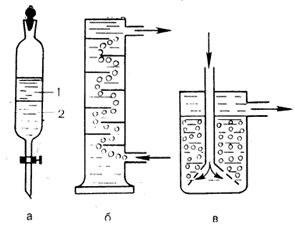
Рис. 1. Прилади для рідинної екстракції: а – ділильна лійка; 1 – органічна фаза; 2 – водна фаза; б – екстракційна колонка; в – апарат із перфорованою лійкою
Перегонка. Багато речовини досить леткі і можуть бути виділені із матеріалу методом аналітичної перегонки (або дистиляції), яка ґрунтується на випаровуванні і конденсації летких компонентів.
Аналітичну перегонку застосовують для відділення і кількісного визначення летких ефірних масел (в рослинній сировині), оцтової кислоти, етилового спирту. Цим методом визначають ацетильні групи (СН3СОО– ) і нітроген в органічних сполуках.
Хроматографія. Метод хроматографії широко застосовують для розділення і аналізу складних сумішей речовин. В основі цього аналізу лежать сорбційні процеси, розподіл речовин між двома фазами і явища осадження. У відповідності з процесами, що лежать в основі методу, розрізняють адсорбційну, розподільну і осадову хроматографію.
Адсорбційна хроматографія. В цьому методі застосовують спеціальні речовини з добре розвинутою поверхнею – адсорбенти, які здатні утримувати на своїй поверхні з різною силою хімічні речовини, як за допомогою хімічного зв’язку, так і за допомогою молекулярних сил і поверхневих явищ.
Йонообмінна хроматографія. Деякі адсорбенти здатні до обміну своїх йонів на йони електроліту з розчину. Такі сорбенти називають йонітами. Йоніти, які здатні обмінювати свої катіони на катіони електроліту, що містяться в розчині, називаються катіонітами; йоніти, які здатні до обміну своїх аніонів, називаються аніонітами. В якості йонообмінних адсорбентів використовують природні і штучні алюмосилікати (бентоніт, цеоліт, польовий шпат, пермутит), а також синтетичні неорганічні йоніти - оксиди і гідроксиди алюмінію, хрому, олова, силікагель, фосформолібдати та органічні смоли – продукти конденсації фенолів із формальдегідом. Смоли являють собою різного роду пластичні маси і називають органолітами.
Процес хроматографії проводять у хроматографічній колонці, яка заповнена адсорбентом. Розподільна хроматографія. Ґрунтується на здатності речовини розподілятись між двома фазами, які не змішуються при русі одна відносно одної. В залежності від участі в процесі фаз розрізняють газорідинну і рідинну хроматографію. У випадку газорідинної хроматографії використовується здатність речовин знаходитись у газоподібному стані в газовій фазі і у розчиненому стані в рідині. Нерухомою фазою служить рідина, яка нанесена на тверду фазу - носій, або стінки капілярної трубки, рухомий - газ, який проходить через шар адсорбенту або капілярні трубки. Робоча колонка в цьому методі поміщається в термостат і нагрівається до 200 – 400 0 С. Проба речовини вноситься в потік газу, випаровується і разом з потоком газу рухається через колонку, де розділяється на індивідуальні речовини. При виході із колонки спеціальні детектори реєструють присутність речовини і подають сигнал на самописець. За місцем розміщення сигналу, який на хроматограмі має вигляд піка, роблять висновок про наявність у суміші тієї чи іншої речовини. Величина площі піку дозволяє зробити висновок про кількість речовини. Цей метод має високу чутливість і вибірковість і знайшов широке застосування при аналізі суміші летких органічних сполук. З усіх видів розподільної хроматографії найширше застосування знайшли колоночна, паперова і тонкошарова хроматографії.
Рідина–рідинна хроматографія. Розділення речовин проходить внаслідок їх різної здатності розділятися між двома рідкими фазами. При контакті двох фаз наступає рівновага, при якій в кожній фазі містяться певні концентрації речовини. При русі однієї фази відносно іншої рівновага порушується і речовина переходить із нерухомої у рухому фазу, вільну від речовини, і навпаки. Суміш речовин при цьому розділяється. В якості нерухомої рідкої фази (хроматографічний шар) використовують пористі матеріали з великою поверхнею, які змочені будь - якою рідиною (часто водою). В якості рухомої фази використовують суміші різних органічних розчинників.
Колоночна хроматографія. Проводять на колонці зі скла, яка заповнена адсорбентом (оксид алюмінію, силікагель та ін.), на який наносять попередньо нерухому рідку фазу. В колонку вносять 0,2-0,5 см3 розчину суміші речовин і потім через неї пропускають рухому фазу і розчин детектуючих (ті, що виявляють) реагентів. Так, для виявлення Fe3+ застосовують розчин амонію тіоціанат, Ni2+ – розчин діацетилдиоксиму, Сu2+ – розчин амоніаку. Рухома фаза проводить розділення йонів, розчин реагенту детектує зони, де знаходяться виявлені йони.
Паперова хроматографія. Ґрунтується на рухові розчинника на спеціальному папері. Якщо кювета з розчинником знаходиться внизу і розчинник рухається по паперу вгору, метод називається висхідною паперовою хроматографією; при рухові розчинника згори до низу – низхідною паперовою хроматографією. Паперова хроматографія проводиться на спеціальному хроматографічному папері. Нерухомою фазою служить волога, яка знаходиться на волокнах паперу, рухомою – розчинник. На смужці паперу помічають стартову лінію, на яку наносять невелику кількість (1–2 каплі) дослідного розчину суміші речовин і стандартів (міток). Підсушують нанесені каплі і занурюють нижній край стрічки паперу в кювету з розчинником, яка поміщена в герметично закриту хроматографічну камеру, попередньо насичену парами розчинника. Це необхідно для попередження випаровування розчинника з паперу. Внаслідок капілярних сил розчинник піднімається по смужці паперу, ділячи суміш на плями індивідуальних речовин. Хроматографію ведуть до тих пір, доки розчинник не пройде 20– 25 см. Смужку підсушують на повітрі і збризкують розчином проявника. Речовини при цьому проявляються у вигляді плям, які забарвлені у різні кольори.
Тонкошарова хроматографія. Проводиться аналогічно паперовій. Тут використовують або готові пластинки із закріпленим шаром сорбенту на фользі або готують тонкий шар сорбенту (силікагель, алюмінію оксид) на скляних пластинках (від скляних негативів).
Осадова хроматографія. Ґрунтується на утворенні осадів речовин з реагентами і різній їх розчинності у розчиннику, який рухається на фільтрувальному чи хроматографічному папері. На папір наносять декілька капель розчину речовини, потім додають розчин реактиву і одержані кольорові осади розганяють током розчинника.
Електрохроматографія, або електрофорез на папері. Ґрунтується на здатності йонів рухатись у розчині під дією електричного поля високої напруги (400–600 В). При цьому катіони рухаються до катоду, аніони - до аноду. Різні йони відрізняються один від одного рухомістю, зарядом і в електричному полі рухаються з різною швидкістю, внаслідок чого проходить їх розділення. Електрофорез проводять у буферному розчині, яким змочують для кращої провідності струму папір, який поміщають у камеру для електрофорезу.
3. Основні метрологічні характеристики методики аналізу
На практиці частіше користуються кількісними методами аналізу, які ґрунтовно розглядаються в аналітичній хімії. Вибір методу дослідження для визначення того чи іншого компонента залежить від потрібної точності аналізу, доступності методу для виконання, вмісту аналізованої речовини, хімічного складу досліджуваного об'єкта тощо
На основі вимірюваних параметрів методи кількісного аналізу поділяють на хімічні, фізико-хімічні, фізичні та біологічні. Часто фізико-хімічні і фізичні методи аналізу називають інструментальними методами через широке застосування різних приладів та інструментів.
При аналізі виникає цілий ряд помилок (похибок), які знижують точність результатів аналізу. Похибки дослідження появляються внаслідок різних причин. Найчастіше помилки допускаються під час неправильного відбору проб зразків середовищ. Є похибки зважування, відмірювання тощо. Взагалі, уникнути похибок досить важко. Похибки можуть бути систематичні і випадкові. Систематичні похибки виникають постійно через неправильність аналітичних ваг, мірного посуду, аналітичних приладів. Для уникнення систематичних похибок необхідні перевірка ваг, калібровка мірного посуду і інших вимірювачів. Випадкові похибки виникають внаслідок різних випадкових причин: додана надлишкова капля титранту, неточно взята наважка речовини тощо. Для уникнення випадкових похибок, проводять не менше трьох паралельних аналізів. Середній результат трьох паралельних визначень в більшій чи меншій мірі вільний від випадкових похибок. У практиці хімічного аналізу випадкові похибки враховують спеціальною математичною обробкою, отримуючи результат аналізу у вигляді певного довірчого інтервалу
Основними метрологічними характеристиками методики аналізу є збіжність, відтворюваність, правильність, точність, чутливість і межа виявлення.
Збіжність – це ступінь близькості один до одного результатів паралельних одиноких вимірювань, виконаних в однакових умовах одним і тим же виконавцем, в один день при використанні одних і тих самих матеріалів і апаратури.
Відтворюваність – це ступінь близькості один до одного результатів одиничних вимірювань, виконаних у різних умовах (наприклад, різними людьми або на різних приладах, у різні дні тощо). Відтворюваність у 1,5 - 2 рази нижча збіжності. Чим вища збіжність і відтворюваність методики (тобто менше стандартне відхилення), тим рідше в одиничних вимірах зустрічаються великі похибки і тим ближчі результати паралельних вимірювань.
Правильність характеризує близькість результатів аналізу до істинного вмісту компонента в зразку. Правильність обумовлена наявністю і значенням систематичних похибок.
Точність відображає близькість до нуля похибок всіх видів (як систематичних, так і випадкових).
Чутливість відображає здатність методу виявити різницю між близькими концентраціями (кількостями) визначуваної речовини. Якщо визначення концентрації проводиться за градуювальною кривою, побудованою за стандартними зразками, то чутливість методу дорівнює тангенсу кута нахилу цієї кривої при даній концентрації.
Межа виявлення характеризує найменший вміст речовини, що визначається, у відповідності з даною довірчою ймовірністю. Межа виявлення визначається за допомогою градуювальної кривої за величиною мінімального аналітичного сигналу, який виявляється. Розрізняють абсолютні і відносні межі виявлення. Абсолютна межа виявлення – це найменша кількість речовини, яку можна виявити даним методом. Вона виражається в одиницях маси – грамах, міліграмах, мікрограмах тощо. Відносна межа виявлення – це найменша концентрація, яка виявляється даним методом, виражається в %, мг/мл, мкг/мл та інше.
Шрифти
Розмір шрифта
Колір тексту
Колір тла
Кернінг шрифтів
Видимість картинок
Інтервал між літерами
Висота рядка
Виділити посилання
Вирівнювання тексту
Ширина абзацу