2. ФІЗИЧНІ ОСНОВИ РАДІОБІОЛОГІЇ
План лекції
1. Будова атому. Ізотопи2. Явище радіоактивності. Закон радіоактивного розпаду
3. Типи іонізуючих випромінювань: електромагнітне та корпускулярне
4. Типи ядерних перетворень
5. Радіометрія і дозиметрія іонізуючих випромінювань.
6. Одиниці радіоактивності і доз
7. Зв’язок між радіоактивністю та дозою іонізуючого випромінювання
8. Види опромінення
9. Взаємодія електромагнітних та корпускулярних випромінювань з речовиною
10. Лінійна передача енергії іонізуючих випромінювань та їх відносна біологічна ефективність
1. Будова атому. Ізотопи
Атом – найменша частинка хімічного елементу, котра зберігає його властивості. Атом складається з позитивно зарядженого ядра і негативно заряджених електронів, які обертаються по орбітах навколо нього. Електрон – найлегша елементарна частинка речовини, яка несе негативний електричний заряд найменш можливої величини, що дорівнює 1,6×10–19. Абсолютна маса електрону складає 9,1×10–28 г. Згідно принципу еквівалентності А. Ейнштейна (Е=mc2, де E – енергія, m – маса і
Енергетичний еквівалент електрону дорівнює заряду ядра, і тому в цілому атом є електрично-нейтральним.
Електрони, що обертаються навколо ядра, мають певну для кожної орбіти енергію. При переході з однієї орбіти на іншу енергія електрону змінюється стрибкоподібно, внаслідок чого при переході на орбіту з меншою енергією (більш віддалену від ядра) він випускає енергію, а при переходу на орбіту з більшою енергією (більш близьку) поглинає електромагнітне випромінювання у вигляді фотонів. Другий процес, який супроводжується збільшенням енергії, називається збудженням електрону. Тому класичне уявлення про електронну орбіту в атомі як певного кола втрачає сенс, так як виявляється, що електрони, яким властиві хвильові властивості, ніби розмазані у просторі і один електрон може перебувати на різній віддалі від ядра. Стало прийнятим говорити про так звану „електронну хмару” в атомі, маючи при цьому саме місце знаходження електрону.
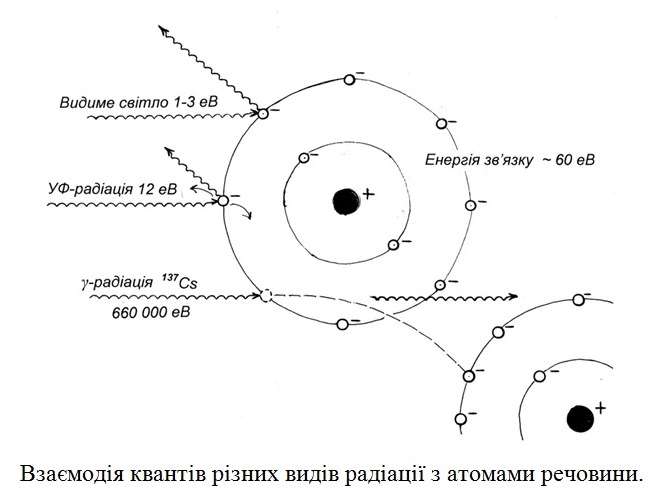
Радіус атому складає біля 10–8 см, а ядра – лише 10–12–10–13 см. Але у ядрі зосереджено до 99,8% маси атому. Воно складається з нуклонів – протонів і нейтронів.
Протон – це елементарна частинка, яка має однаковий з електроном електричний заряд, але позитивний. Маса протону у 1836 разів більша за масу електрону, тобто складає 1,67.10–24 г. Протон – це ядро самого простого за фізичною будовою елемента – атому водню, позитивний заряд котрого нейтралізується негативним зарядом одного тільки електрону.
Нейтрон – електрично-нейтральна частинка масою, що дорівнює масі протону. У зв’язку з тим, що нейтрон не має заряду, він не взаємодіє з електрично-зарядженими частинками, не відхиляється в магнітному полі. Тому проникаюча здатність нейтрону у речовину досить значна.
Вважається, що і протон, і нейтрон є одними й тими ж частинками, тільки такими, що знаходяться у різних „зарядових” станах, котрі за певних умов можуть переходити одна в одну.
Атомне ядро включає у себе також багато інших елементарних частинок, в тому числі електрони, позитрони, нейтрино, антинейтрино, мезони.
З радіобіологічної точки зору, крім електронів, з них, як можливий тип іонізуючих випромінювань, цікавість являють позитрони. Позитрон – частинка, ідентична за своїми властивостями електрону, але така, що має еквівалентний позитивний заряд.
Не дивлячись на те, що ці частинки нібито додатково, крім нуклонів, входять до складу ядра, маса ядра у вільному стані менша за суму мас його протонів і нейтронів. Це не зовсім зрозуміле поняття із звичайної точки зору одержало назву дефект маси. Воно пояснюється тим, що при поєднанні нуклонів у атомне ядро частина маси не щезає безслідно, а уноситься з випромінюванням, що випускається при виникненні такої системи.
Щільність ядра надзвичайно велика, досягаючи величезних, котрі важко уявити, значень – 214 г/см3, або 200 млн. т/см3.
Атоми з однаковою кількістю протонів, але різною кількістю нуклонів (а, відповідно, різною масою) називають ізотопами.
Існують атоми із стійкими – стабільними і нестійкими – радіоактивними ядрами. У ізотопів елементів, що розташовані у періодичній системі елементів після вісмуту, тобто починаючи з елементу полонію з порядковім номером 84, всі ядра атомів радіоактивні.
У цьому розділі і протягом усієї книги будуть вживатися такі поняття: радіоактивний ізотоп, радіоактивний елемент, радіоактивна речовина і радіонуклід. Між ними багато спільного, проте їх треба розрізняти.
Радіоактивний ізотоп, або радіоізотоп, – це нестійкий ізотоп, що розпадається. Так, елемент калій складається з трьох ізотопів – 39К, 40К і 41К. Перший і третій з них – стійкі, стабільні, а 40К – нестійкий, радіоактивний. Терміни „ізотоп”, „радіоактивний ізотоп” використовується звичайно тоді, коли говориться про атоми одного і того ж елементу.
Радіоактивний елемент – це хімічний елемент, всі ізотопи якого радіоактивні. Наприклад, природний уран, який складається з трьох радіоактивних ізотопів – 234U, 235U і 238U, а також торій, полоній, плутоній, америцій та інші, у склад яких входять виключно радіоактивні ізотопи.
Радіоактивна речовина – це речовина, до складу якої входить радіоактивний ізотоп. При цьому слід розуміти тільки хімічні сполучення атомів елементів, до складу котрих входять радіоактивні ізотопи. Наприклад, 3H2O, 40КСl, K235SO4,235UO2, 90SrSO4, 137CsNO3.
Нукліди – це загальна назва атомів, що відрізняються кількістю нуклонів у ядрі або при однаковій кількості нуклонів містять різну кількість протонів чи нейтронів. Радіонуклід, або радіоактивний нуклід, – це нестійкий, такий, що розпадається, нуклід. Термін „радіонуклід” звичайно застосовують для визначення атомів радіоактивних речовин, так як радіоактивні ізотопи, як правило, бувають у складі сполук і дуже рідко у вільному стані. Так, говорять про радіонукліди 89Sr і 90Sr, 134Сs і 137Сs, 131І і 132І і т.д. В принципі поняття „радіонуклід” близьке поняттю „радіоізотоп”.
Що ж таке радіоактивність, зумовлена нестійкість атомних ядер?
Шрифти
Розмір шрифта
Колір тексту
Колір тла
Кернінг шрифтів
Видимість картинок
Інтервал між літерами
Висота рядка
Виділити посилання
Вирівнювання тексту
Ширина абзацу
